题目内容
19.能正确表示下列反应的离子方程式是( )| A. | 过氧化钠固体与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 向明矾[KAl(SO4)2]溶液中逐滴加入Ba(OH)2溶液至SO42-恰好沉淀完全:2Al3++3SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| C. | FeSO4酸性溶液暴露在空气中:4Fe2++O2+4H+═4Fe3++2H2O | |
| D. | 向次氯酸钠溶液中通入少量SO2:ClO-+SO2+H2O═Cl-+SO42-+H+ |
分析 A.过氧化钠在离子反应中保留化学式;
B.硫酸根离子恰好沉淀完全时,铝离子与氢氧根离子的物质的量之比为1:4,反应生成偏铝酸根离子,不是生成氢氧化铝沉淀;
C.亚铁离子容易被空气中的氧气氧化成铁离子;
D.离子方程式两边电荷不相等,违反了电荷守恒.
解答 解:A.过氧化钠与水反应生成氢氧化钠和氧气,正确的离子反应为:2Na202+2H2O═40H-+4Na++O2↑,故A错误;
B.向Ba(OH)2溶液中,逐滴加入明矾溶液至Ba2+恰好完全沉淀,铝离子完全反应生成偏铝酸根离子,反应的离子方程式为:Al3++2SO42-+4OH-+2Ba2+═2BaSO4↓+AlO2-+2H2O,故B错误;
C.FeSO4酸性溶液暴露在空气中,亚铁离子被氧气氧化,反应的离子方程式为:4Fe2++O2+4H+═4Fe3++2H2O,故C正确;
D.次氯酸钠溶液中通入少量SO2,反应生成硫酸和氯化钠,正确的离子方程式为:ClO-+SO2+H2O═Cl-+SO42-+2H+,故D错误;
故选C.
点评 本题考查离子反应方程式的书写,为高频考点,题目难度中等,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应考查.

练习册系列答案
相关题目
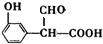
9.伞形酮可用作荧光指示剂和酸碱指示剂,其合成方法如图所示,下列有关这三种物质的说法正确的是( )


| A. | 雷琐苯乙酮所有碳原子不可能共平面 | |
| B. | 雷琐苯乙酮、伞形酮能用酸性KmnO4鉴别 | |
| C. | 1mol雷琐苯乙酮跟足量H2反应,最多消耗3molH2 | |
| D. | 1mol伞形酮与足量NaOH溶液反应,最多消耗3molNaOH |
7.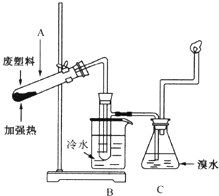 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图所示.加热聚丙烯废塑料得到的产物如下表所示:
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图所示.加热聚丙烯废塑料得到的产物如下表所示:
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔.

写出反应②、③的化学方程式CaC2+2H2O→Ca(OH)2+C2H2↑,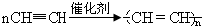 .
.
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有4种.
(3)锥形瓶C中观察到的现象是棕黄色溶液变无色或褪色,经溴水充分吸收后,剩余气体经干燥后平均相对分子质量为4.8.
(4)写出C中逸出的气体在工业上的两种用途合成氨原料、作燃料或有机化工原料.
 某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图所示.加热聚丙烯废塑料得到的产物如下表所示:
某些废旧塑料可采用下列方法处理,将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如图所示.加热聚丙烯废塑料得到的产物如下表所示:| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 炭 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |

写出反应②、③的化学方程式CaC2+2H2O→Ca(OH)2+C2H2↑,
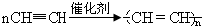 .
.(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有4种.
(3)锥形瓶C中观察到的现象是棕黄色溶液变无色或褪色,经溴水充分吸收后,剩余气体经干燥后平均相对分子质量为4.8.
(4)写出C中逸出的气体在工业上的两种用途合成氨原料、作燃料或有机化工原料.



 (或
(或 、
、 )
) .
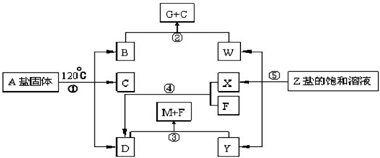
.
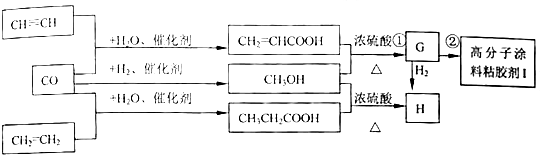
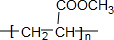 ;
;