题目内容
6.某容器中发生一个化学反应,反应过程中存在H2O、ClO-、NH3、N2、Cl-五种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )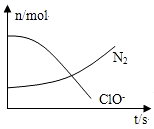
| A. | 还原剂是NH3,氧化产物是Cl- | |
| B. | 配平后氧化剂与还原剂的计量系数之比为3:2 | |
| C. | 该反应中氧化反应过程是ClO-→Cl- | |
| D. | 标准状况下,若生成2.24LN2,则转移电子为0.5 mol |
分析 由曲线变化图可知,随反应进行N2的物质的量增大,故N2是生成物,则NH3应是反应物,N元素化合价发生变化,ClO-的物质的量减少,则ClO-为反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2NH3=N2↑+3H2O+3Cl-,以此解答该题.
解答 解:由曲线变化图可知,随反应进行N2的物质的量增大,故N2是生成物,则NH3应是反应物,N元素化合价发生变化,ClO-的物质的量减少,则ClO-为反应物,由氯元素守恒可知Cl-是生成物,则反应的方程式应为3ClO-+2NH3=N2↑+3H2O+3Cl-,
A、反应中,N元素化合价由NH3中-3价升高为N2中0价,可知NH3为还原剂,氧化产物为N2,故A错误;
B、反应中ClO-为氧化剂,NH3为还原剂,根据反应方程式可知,氧化剂与还原剂的计量系数之比为3:2,故B正确;
C、该反应中Cl元素的化合价降低被还原,则该反应的还原反应过程是ClO-→Cl-,故C错误;
D、反应中生成1molN2转移的电子为6mol,则生成2.24LN2(标准状况)即物质的量为0.1mol时,转移电子为0.6mol,故D错误.
故选:B.
点评 本题考查氧化还原反应计算、基本概念等,难度中等,根据曲线变化图分析反应物、产物,利用守恒生成方程式是关键.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
16.下列有关物质的性质与应用相对的是( )
| A. | PbO2具有氧化性和导电性,故可作为铅蓄电池的负极材料 | |
| B. | 炭具有还原性,一定条件下能 将二氧化硅还原为硅 | |
| C. | 酒精能使蛋白质溶液沉淀析出,可以用来分离提纯蛋白质溶液 | |
| D. | Al的金属较强,可用作飞机火箭的结构材料 |
17.下列有关物质的应用说法正确的是( )
| A. | 生石灰用作食品抗氧化剂 | |
| B. | FeCl3溶液能被铜置换,可用于铜质印刷线路板制作 | |
| C. | 铁红常用作红色油漆和涂料 | |
| D. | 氢氧化钡可作胃酸的中和剂 |
2.下列物质不属于有机物的是( )
| A. | 碳 | B. | 甲烷 | C. | 醋酸 | D. | 乙醇 |

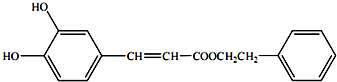
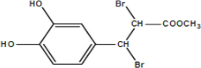
 (或
(或 、
、 )
) .
.
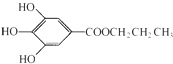 ,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.
,是白色粉末,难溶于水,微溶于棉子油等油脂,是常用的食用油抗氧化剂.