题目内容
20.下列叙述中,错误的是( )| A. | 乙烯不能使酸性高锰酸钾溶液褪色 | |
| B. | 苯不能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇可以和金属钠反应放出氢气 | |
| D. | 乙酸可以与乙醇在一定条件下发生酯化反应 |
分析 A.乙烯含有碳碳双键,可被氧化;
B.苯结构稳定,性质稳定;
C.乙醇含有羟基,可与钠反应;
D.乙酸含有羧基,乙醇含有羟基,可发生酯化反应.
解答 解:A.乙烯含有碳碳双键,可与高锰酸钾发生氧化还原反应,故A错误;
B.苯结构稳定,性质稳定,与高锰酸钾不反应,故B正确;
C.乙醇含有羟基,可与钠反应生成氢气,故C正确;
D.乙酸含有羧基,乙醇含有羟基,在浓硫酸作用下加热可发生酯化反应,故D正确.
故选A.
点评 本题考查有机物的结构和性质,为高频考点,侧重双基的考查,有利于培养学生良好的科学素养,提高学习的积极性,注意把握有机物的结构和官能团的性质,难度不大.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
10.下列有关说法错误的是( )
| A. | 已知氯化钴及其水合物会呈现不同颜色(如下),德国科学家发明了添加氯化钴的变色水泥,据此推测雨天变色水泥呈粉红色 | |
| B. | 已知铬酸根(黄色)和重铬酸根(橙色)离子间存在如下平衡:2CrO42-+2H+?Cr2O72-+H2O,若加水稀释,则溶液中所有离子浓度均减少 | |
| C. | 若反应2A(g)+B(s)?C(g)+3D(g)只有高温下才能自发进行,则该反应的△H>0 | |
| D. | 增大反应物的浓度,可使单位体积内活化分子数目增多,反应速率加快 |
11.下列离子方程式正确的是( )
| A. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-═CaCO3↓ | |
| B. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | NaHCO3和过量的澄清石灰水反应:2HCO3-+2OH-+Ca2+═CaCO3↓+CO32-+2H2O | |
| D. | NH4HSO3溶液与足量NaOH溶液混合加热:NH4++HSO3-+2OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+SO32-+2H2O |
8.根据表中信息判断,下列选项不正确的是( )
| 序号 | 反应物 | 产物 |
| ① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
| ② | Cl2、FeBr2 | FeCl3、FeBr3 |
| ③ | MnO4- | Cl2、Mn2+ |
| A. | 第①组反应的其余产物为H2O和 O2 | |
| B. | 氧化性由强到弱顺序为MnO4->Cl2>Fe3+>Br2 | |
| C. | 第③组反应中生成1mol Cl2,转移电子2mol | |
| D. | 第②组反应中Cl2与 FeBr2的物质的量之比为1:2 |
15.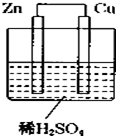 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
实验后的记录:
①Zn为正极,Cu为负极
②Cu极上有气泡产生,发生还原反应
③SO42-向Zn极移动
④若有0.5mol电子流经导线,则产生5.6L气体
⑤电流的流向是:Cu→Zn
⑥负极反应式:Cu-2e-═Cu2+,发生氧化反应.
 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录卡如下,则卡片上的描述合理的是( )实验后的记录:
①Zn为正极,Cu为负极
②Cu极上有气泡产生,发生还原反应
③SO42-向Zn极移动
④若有0.5mol电子流经导线,则产生5.6L气体
⑤电流的流向是:Cu→Zn
⑥负极反应式:Cu-2e-═Cu2+,发生氧化反应.
| A. | ②④⑤ | B. | ②③⑤ | C. | ①④⑥ | D. | ③④⑤⑥ |
16.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石.已知12g石墨完全转化为金刚石时,要吸收QkJ的能量,下列说法正确的是( )
| A. | 金刚石与石墨互为同位素 | |
| B. | 石墨石稳定 | |
| C. | 金刚石稳定 | |
| D. | 等质量的石墨与金刚石完全燃烧,石墨放出的能量多 |
17.已知相同浓度的NH4Cl和FeCl3溶液pH是前者小于后者,在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
| A. | Fe2++SO42-+Ba2++2OH-═BaSO4↓+Fe(OH)2↓ | |
| B. | NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O | |
| C. | 2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |
| D. | 3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O |