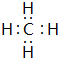题目内容
7.下列关于丙烯(CH3-CH=CH2)的说法正确的是( )| A. | 丙烯分子有8个σ键,1 个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子不存在非极性键 | |
| D. | 丙烯分子中3个碳原子可能在同一直线上 |
分析 共价单键为δ键,双键中有1个δ键,1个π键,甲基中的C为sp3杂化,双键中的C为sp2杂化,结合化学键及乙烯的平面结构分析.
解答 解:A.C-C、C-H键均为σ键,C=C中一个σ键,一个π键,则丙烯分子有8个σ键,1个π键,故A正确;
B.甲基中的C原子为sp3杂化,C=C中的C原子为sp2杂化,则丙烯分子中1个碳原子是sp3杂化,2个碳原子是sp2杂化,故B错误;
C.同种非元素之间形成非极性键,则丙烯中存在C-C非极性共价键,故C错误;
D.由C=C双键为平面结构、甲基为四面体结构可知,丙烯分子中2个碳原子在同一直线,故D错误.
故选A.
点评 本题考查分子结构与化学键,注意判断共价键的一般规律及乙烯的平面结构,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
17.已知相同浓度的NH4Cl和FeCl3溶液pH是前者小于后者,在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是( )
| A. | Fe2++SO42-+Ba2++2OH-═BaSO4↓+Fe(OH)2↓ | |
| B. | NH4++Fe3++2SO42-+2Ba2++4OH-═2BaSO4↓+Fe(OH)3↓+NH3•H2O | |
| C. | 2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |
| D. | 3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
18.决定化学反应速率的主要因素是( )
| A. | 反应物的浓度 | B. | 温度、压强以及反应物的接触面积 | ||
| C. | 催化剂 | D. | 参加反应的物质本身的性质 |
15.常温下,下列各组离子在pH=1和pH=13的条件下,都能大量共存的是( )
| A. | Al3+ Mg2+ Cl- SO42- | B. | K+ Na+ Cl- HCO3- | ||
| C. | Fe2+ K+ NO3- SO42- | D. | K+ Ba2+ NO3- Cl- |
16.下列物质既能与盐酸反应,又能与烧碱溶液反应的是( )
①Al2O3 ②Al(OH)3 ③Al ④NaHCO3 ⑤NaHS ⑥CaCO3 ⑦NaHSO4 ⑧(NH4)2CO3.
①Al2O3 ②Al(OH)3 ③Al ④NaHCO3 ⑤NaHS ⑥CaCO3 ⑦NaHSO4 ⑧(NH4)2CO3.
| A. | 除⑥外 | B. | 除⑥、⑦外 | C. | 除⑥、⑦、⑧外 | D. | 除①、②、③、④、⑤外 |
 .
.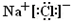 ,Na在F单质中燃烧的产物是Na2O2.
,Na在F单质中燃烧的产物是Na2O2.
 .
.