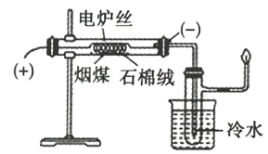
题目内容
【题目】下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述不正确的
元素代号 | A | B | C | D | E | N | G |
原子半径 |
|
|
|
|
|
|
|
主要化合价 |
|
|
|
|
|
|
|
A.稳定性:HG>HN;熔沸点:HG>HN
B.工业上常用电解熔融DN3的方法冶炼D单质
C.B、C原子的最外层子电子数相同
D.![]() 的最高价氧化物的水化物溶液的pH:
的最高价氧化物的水化物溶液的pH:![]()
【答案】B
【解析】
各元素均为短周期元素,E的化合价为![]() 、
、![]() ,则E为S元素;A的原子半径大于S,化合价为
,则E为S元素;A的原子半径大于S,化合价为![]() ,则A为Na元素;N、G的主要化合价都为
,则A为Na元素;N、G的主要化合价都为![]() ,说明二者位于ⅤⅡA族,根据原子半径可知,N为Cl、G为F元素;D的化合价为
,说明二者位于ⅤⅡA族,根据原子半径可知,N为Cl、G为F元素;D的化合价为![]() ,原子半径大于Cl元素,则D为Al元素;B、C的化合价都为
,原子半径大于Cl元素,则D为Al元素;B、C的化合价都为![]() ,根据原子半径
,根据原子半径![]() 可知,B为Mg元素,C为Be元素,据此结合元素周期律知识解答。
可知,B为Mg元素,C为Be元素,据此结合元素周期律知识解答。
A. 非金属性越强,对应气态氢化物的稳定性越强,则非金属性:![]() ,则气态氢化物的稳定性:
,则气态氢化物的稳定性:![]() ;由于HF能形成分子间氢键,使沸点反常的升高,熔沸点
;由于HF能形成分子间氢键,使沸点反常的升高,熔沸点![]() ,故A正确;
,故A正确;
B. 氯化铝为共价化合物,工业上用电解熔融的氧化铝的方法而不是氯化铝来制备金属铝,故B错误;
C. B为Mg元素,C为Be元素,最外层电子数相同,故价电子数相等,故C正确;
D. A的最高价氧化物的水化物为氢氧化钠,N为高氯酸,相同浓度时两者的pH不等,故D正确;
故选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
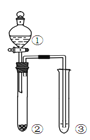
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D