题目内容
【题目】下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物B在常温常压下为气体,B和C的相对分子质量之比为4∶5,化合物D是重要的工业原料。
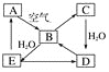
(1)写出B与足量硝酸钡溶液反应的离子方程式:___________。
(2)写出E与A的氢化物反应生成A的化学方程式:________。
(3)将5 mL 0.10 mol·L-1的E溶液与10 mL 0.10 mol·L-1的NaOH溶液混合。反应后溶液的pH______7(填“大于”、“小于”或“等于”),理由用离子方程式表示_______________;
【答案】3SO2 +2H2O +3Ba2++2NO3- =2NO↑+3BaSO4↓+4H+ H2SO3+2H2S=3S↓+3H2O 大于 SO32-+ H2O![]() HSO3-+OH-
HSO3-+OH-
【解析】
固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2,C为SO3,它们的相对分子质量为64:80=4:5,恰好与题意相符(同时也证明A不是C),则D为H2SO4,它是一种重要的工业原料,与题意也相符,进一步证明A为S,E为H2SO3,结合物质的性质以及题目要求可解答该题。
(1)B为SO2,与足量硝酸钡反应会被氧化成硫酸根,继而生成硫酸钡沉淀,
故答案为:3SO2 +2H2O +3Ba2++2NO3- =2NO↑+3BaSO4↓+4H+;
(2)H2SO3与H2S反应生成S,反应的方程式为H2SO3+2H2S═3S↓+3H2O,故答案为:H2SO3+2H2S═3S↓+3H2O;
(3)反应生成Na2SO3,为强碱弱酸盐,水解呈碱性,溶液pH>7,
故答案为:大于;SO32-+ H2O![]() HSO3-+OH-;
HSO3-+OH-;

 阅读快车系列答案
阅读快车系列答案【题目】下列实验操作对应的现象不符合事实的是
选项 | 实验操作 | 现象 |
A | 向盛有 | 溶液逐渐变为黄色,滴加KSCN后溶液变血红色 |
B | 向盛有 | 溶液逐渐褪色,静置后观察到溶液有分层现象 |
C | 向 | 先产生白色沉淀,后沉淀消失 |
D | 向盛有 | 有刺激性气味气体产生,溶液变浑浊 |
A.AB.BC.CD.D
【题目】下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述不正确的
元素代号 | A | B | C | D | E | N | G |
原子半径 |
|
|
|
|
|
|
|
主要化合价 |
|
|
|
|
|
|
|
A.稳定性:HG>HN;熔沸点:HG>HN
B.工业上常用电解熔融DN3的方法冶炼D单质
C.B、C原子的最外层子电子数相同
D.![]() 的最高价氧化物的水化物溶液的pH:
的最高价氧化物的水化物溶液的pH:![]()
【题目】表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是( )
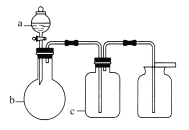
选项 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
B | SO2 | 70%的浓H2SO4 | Na2SO3固体 | 98%的浓H2SO4 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A.AB.BC.CD.D