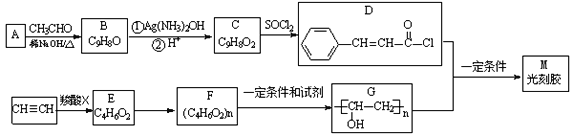
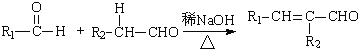
题目内容
【题目】按要求完成下列空格
Ⅰ.为减少SO2的排放,常采取以下措施,将煤转化为清洁的气体燃料。已知:
①H2(g)+![]() O2(g)=H2O(g) ΔH1=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8kJ·mol-1
②C(s)+![]() O2(g)=CO(g) ΔH2=-110.5kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5kJ·mol-1
写出焦炭与水蒸气反应的热化学方程式____________。
Ⅱ.将等物质的量的A、B混合于2L的密闭容器中,发生如下反应:3A(g) +B(g) ![]() xC(g) +2D(g),经5min后,测得D的浓度为0.5molL﹣1,C的平均反应速率是0.1mol/(Lmin),且此时A的物质的量浓度为0.25molL﹣1。
xC(g) +2D(g),经5min后,测得D的浓度为0.5molL﹣1,C的平均反应速率是0.1mol/(Lmin),且此时A的物质的量浓度为0.25molL﹣1。
(1)x的值是_____;
(2)B的平均反应速率_____;
(3)则反应开始前放入容器中A的物质的量_____。
Ⅲ.(1)CO2,NaCl,Na,Si,CS2,五种物质的熔点由高到低的顺序是________(用分子式或化学式表示)。
(2)A、B、C、D为四种晶体,性质如下:
A固态时能导电,能溶于盐酸;B能溶于CS2,不溶于水;
C固态时不导电,液态时能导电,可溶于水;D固态、液态时均不导电,熔点为3500 ℃;
试推断它们的晶体类型:A_____;B_____;C_____;D_____。
(3)磷和氯气反应可生成组成比为1∶3的化合物,该化合物的立体构型为_____,中心原子的杂化轨道类型为_____,中心原子的价层电子对数为_____。
【答案】C(s)+H2O(g)=CO(g)+H2(g) ΔH=+131.3kJ·mol-1 2 0.05mol/(Lmin) 2mol Si>NaCl>Na>CS2>CO2 金属晶体 分子晶体 离子晶体 原子晶体 三角锥形 sp3 4
【解析】
I.(1)根据盖斯定律分析解答;
Ⅱ.根据υ=![]() 计算υ(D),再根据反应速率之比等于化学计量数之比分析解答;
计算υ(D),再根据反应速率之比等于化学计量数之比分析解答;
Ⅲ.(1)一般而言,物质的熔点由高到低的顺序为原子晶体>离子晶体>分子晶体,据此分析排序;
(2)根据晶体的物理性质分析判断;
(3)根据价层电子对数=σ键电子对数+孤电子对数=σ键电子对数+![]() (a-xb)计算判断。
(a-xb)计算判断。
I.①H2 (g)+![]() O2 (g)=H2O(g) △H=-241.8 kJ/mol,②C (s)+
O2 (g)=H2O(g) △H=-241.8 kJ/mol,②C (s)+![]() O2 (g)=CO (g) △H=-110.5kJ/mol,根据盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g) △H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,故答案为:C(s)+H2O(g)=CO(g)+H2(g) △H=+13l.3 kJ/mol;
O2 (g)=CO (g) △H=-110.5kJ/mol,根据盖斯定律,将②-①可得C(s)+H2O(g)=CO(g)+H2(g) △H=(-110.5kJ/mol)-(-241.8kJ/mol)=+13l.3 kJ/mol,故答案为:C(s)+H2O(g)=CO(g)+H2(g) △H=+13l.3 kJ/mol;
Ⅱ.(1)经5min后,测得D的浓度为0.5molL-1,则υ(D)=![]() =0.1mol/(Lmin),C的平均反应速率是0.1mol/(Lmin),则:0.1mol/(Lmin)∶0.1mol/(Lmin)=2∶x,解得x=2,故答案为:2;
=0.1mol/(Lmin),C的平均反应速率是0.1mol/(Lmin),则:0.1mol/(Lmin)∶0.1mol/(Lmin)=2∶x,解得x=2,故答案为:2;
(2)速率之比等于化学计量数之比,υ(B)=![]() υ(D)=
υ(D)=![]() ×0.1mol/(Lmin)=0.05mol/(Lmin),故答案为:0.05mol/(Lmin);
×0.1mol/(Lmin)=0.05mol/(Lmin),故答案为:0.05mol/(Lmin);
(3)速率之比等于化学计量数之比,υ(A)=![]() υ(D)=
υ(D)=![]() ×0.1mol/(Lmin)=0.15mol/(Lmin),则反应开始前A的物质的量浓度为0.25molL﹣1+0.15mol/(Lmin)×5min=1molL﹣1,反应开始前放入容器中A的物质的量=1molL﹣1×2L=2mol,故答案为:2mol;
×0.1mol/(Lmin)=0.15mol/(Lmin),则反应开始前A的物质的量浓度为0.25molL﹣1+0.15mol/(Lmin)×5min=1molL﹣1,反应开始前放入容器中A的物质的量=1molL﹣1×2L=2mol,故答案为:2mol;
Ⅲ.(1)一般而言,物质的熔点由高到低的顺序为:原子晶体>离子晶体>分子晶体,Si是原子晶体,熔点最高,CO2和CS2都是分子晶体,相对分子质量越大,熔点越高,所以熔点CS2>CO2;NaCl是离子晶体,熔点比硅低,金属钠的熔点较低,不高于100℃,常温下为固体,因此熔点由高到低的顺序为:Si>NaCl>Na>CS2>CO2,故答案为:Si>NaCl>Na>CS2>CO2;
(2)A固态时能导电,能溶于盐酸,属于金属晶体;B能溶于CS2,不溶于水,属于分子晶体;C固态时不导电,液态时能导电,可溶于水,属于离子晶体;D固态、液态时均不导电,熔点为3 500℃,属于原子晶体,故答案为:金属晶体;分子晶体;离子晶体;原子晶体;
(3)磷和氯反应可生成组成比为1∶3的化合物为PCl3,该化合物中P原子的价层电子对数为3+![]() ×(53×1)=3+1=4,中心原子的杂化轨道类型为sp3杂化,立体构型为三角锥形,故答案为:三角锥形;sp3;4。
×(53×1)=3+1=4,中心原子的杂化轨道类型为sp3杂化,立体构型为三角锥形,故答案为:三角锥形;sp3;4。

 教学练新同步练习系列答案
教学练新同步练习系列答案【题目】下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述不正确的
元素代号 | A | B | C | D | E | N | G |
原子半径 |
|
|
|
|
|
|
|
主要化合价 |
|
|
|
|
|
|
|
A.稳定性:HG>HN;熔沸点:HG>HN
B.工业上常用电解熔融DN3的方法冶炼D单质
C.B、C原子的最外层子电子数相同
D.![]() 的最高价氧化物的水化物溶液的pH:
的最高价氧化物的水化物溶液的pH:![]()