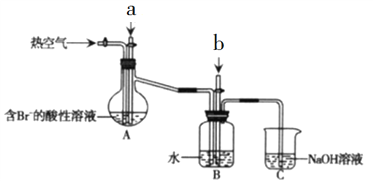
题目内容
【题目】乙炔(C2H2)在气焊、气割及有机合成中用途非常广泛,可由电石(CaC2)直接水化法或甲烷在1500℃左右气相裂解法生产。
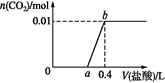
(1)电石水化法制乙炔是将生石灰与焦炭在3000℃下反应生成CaC2,CaC2再与水反应即得到乙炔。CaC2与水反应的化学方程式为____
(2)已知:CH4(g)+2O2(g)===CO2(g)+2H2O(1) △H1=-890.3kJ/mol
C2H2(g)+2.50(g)===2CO2(g)+H2O(1) △H2=-1299.6J/mol
2H2(g)+O2(g)=2H2O(1) △H3=-571.6kJ/mol
则甲烷气相裂解反应:2CH4(g)===C2H2(g)+3H2(g)的△H=_____kJ/mol。
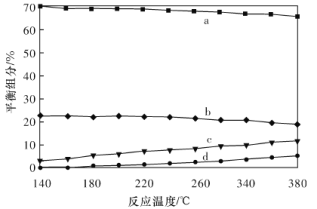
(3)哈斯特研究得出当甲烷分解时,几种气体平衡时分压(Pa)与温度(℃)的关系如图所示。
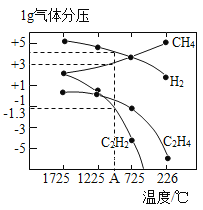
①T1℃时,向1L恒容密闭容器中充入0.3 mol CH4只发生反应2CH4(g)![]() C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
C2H4(g)+2H2(g),达到平衡时,测得c(C2H4)=c(CH4)。该反应的△H____0(填“>”或“<”),CH4的平衡转化率为____%(保留3位有效数字)。上述平衡状态某一时刻,若改变温度至T2℃,CH4以0.01mol/(L·s)的平均速率增多,经ts后再次达到平衡,平衡时,c(CH4)=2c(C2H4),则T1_____(填“>”或“<”)T2,t=______s。
②列式计算反应2CH4(g)![]() C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
C2H2(g)+3H2(g)在图中A点温度时的平衡常数K=____(用平衡分压代替平衡浓度计算,lg0.05=-1.3)。
③由图可知,甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,除改变温度外,还可采取的措施有___________。
【答案】CaC2+2H2O→Ca(OH)2+C2H2↑ +376.4kJ/mol > 66.7% > 5 5×104 可以充入适量的乙烯
【解析】
(1)碳化钙和水反应生成氢氧化钙和乙炔;
(2)根据盖斯定律来分析;
(3)①分解反应绝大多数为吸热反应;设出CH4的转化浓度,然后根据三段式,利用c(C2H4)=c(CH4)来解答;根据改变温度后,CH4的浓度升高来判断温度的变化;表示出变化后的CH4和C2H4的浓度,然后根据c(CH4)=2c(C2H4)来计算;
②根据平衡常数表达式来计算;
③甲烷裂解制乙炔有副产物乙烯生成,为提高甲烷制乙炔的转化率,可以充入适量的乙烯。
(1)碳化钙和水反应生成氢氧化钙和乙炔,反应的化学方程式为:CaC2+2H2O→Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑;
(2)将已知反应依次编号为①、②、③,由盖斯定律将①×4-②-③×![]() 可得:2CH4(g)=C2H2(g)+3H2(g),则△H=(-890.3kJmol-1)×4-(-1299.6kJmol-1)-(-571.6kJmol-1)×
可得:2CH4(g)=C2H2(g)+3H2(g),则△H=(-890.3kJmol-1)×4-(-1299.6kJmol-1)-(-571.6kJmol-1)×![]() =+376.4kJ/mol,故答案为:+376.4kJ/mol;
=+376.4kJ/mol,故答案为:+376.4kJ/mol;
(3)①升高温度,平衡向吸热反应方向移动,由图可知,温度升高,C2H4的平衡分压增大,说明反应2CH4(g)![]() C2H4(g)+2H2(g)向正反应方向移动,则该反应为吸热反应;设平衡时C2H4的平衡浓度为Xmol,由题给数据建立如下三段式:
C2H4(g)+2H2(g)向正反应方向移动,则该反应为吸热反应;设平衡时C2H4的平衡浓度为Xmol,由题给数据建立如下三段式:
2CH4(g)![]() C2H4(g)+2H2(g)
C2H4(g)+2H2(g)
起(mol/L)0.3 0 0
变(mol/L)2X X 2X
平(mol/L)0.3—2X X 2X
由c(C2H4)=c(CH4)可得0.3—2X=X,解得X=0.1mol,CH4的平衡转化率=![]() ×100%=66.7%;改变温度后,CH4的浓度升高,说明平衡向正反应方向移动,则温度应为降低,即T1>T2;由于CH4以0.01mol/(Ls)的平均速率增多,经ts后再次达到平衡,故在ts的时间内,CH4的浓度变化为0.01tmol/L,利用三段式来计算:
×100%=66.7%;改变温度后,CH4的浓度升高,说明平衡向正反应方向移动,则温度应为降低,即T1>T2;由于CH4以0.01mol/(Ls)的平均速率增多,经ts后再次达到平衡,故在ts的时间内,CH4的浓度变化为0.01tmol/L,利用三段式来计算:
2CH4(g)![]() C2H4(g)+2H2(g)
C2H4(g)+2H2(g)
起(mol/L)0.1 0.1 0.2
变(mol/L)0.01t 0.005t 0.01t
平(mol/L)0.1+0.01t 0.1—0.005t 0.2—0.01t
由c(CH4)=2c(C2H4)可得0.1+0.01t=2×(0.1-0.005t),解得t=5S,故答案为:>;66.7%;>;5;
②由图中数据可知,A点温度时,C2H2平衡分压为0.05 Pa,H2平衡分压为104Pa,CH4平衡分压为103Pa,则平衡常数K=![]() =5×104 Pa,故答案为:5×104;
=5×104 Pa,故答案为:5×104;
③甲烷裂解制乙炔有副产物乙烯生成,充入适量的乙烯,可抑制甲烷向乙烯的转化,从而提高甲烷制乙炔的转化率,故答案为:可以充入适量的乙烯。