题目内容
【题目】某稀硫酸和稀硝酸的混合溶液![]() ,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解
,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解![]() 。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示
。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示![]() 已知硝酸只被还原为NO气体
已知硝酸只被还原为NO气体![]() 。下列分析或结果错误的是
。下列分析或结果错误的是![]()
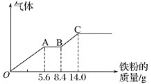
A.原混合酸中![]() 物质的量为
物质的量为![]()
B.OA段产生的是NO,AB段的反应为![]() ,BC段产生氢气
,BC段产生氢气
C.第二份溶液中最终溶质为![]()
D.![]() 浓度为
浓度为![]()
【答案】D
【解析】
由图象可知,由于铁过量,OA段发生反应为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,AB段发生反应为:Fe+2Fe3+=3Fe2+,BC段发生反应为:Fe+2H+=Fe2++H2↑。
A、根据图像可知,由于铁过量,OA段发生反应为:![]() ,硝酸全部起氧化剂作用,所以每份混合酸中
,硝酸全部起氧化剂作用,所以每份混合酸中![]() ,所以原混合酸中
,所以原混合酸中![]() 物质的量为
物质的量为![]()
![]() ,故A正确;
,故A正确;
B、由图象可知,由于铁过量,OA段发生反应为:![]() ,AB段发生反应为:
,AB段发生反应为:![]() ,BC段发生反应为:
,BC段发生反应为:![]() ,故B正确;
,故B正确;
C、硝酸全部被还原,没有显酸性的硝酸,因为溶液中有硫酸根,并且铁单质全部转化为亚铁离子,所以溶液中最终溶质为![]() ,故C正确;
,故C正确;
D、反应最终消耗![]() 铁,物质的量=
铁,物质的量=![]() =0.25mol,铁元素都在硫酸亚铁中,根据硫酸根守恒可知,每份含硫酸
=0.25mol,铁元素都在硫酸亚铁中,根据硫酸根守恒可知,每份含硫酸![]() ,所以硫酸的浓度是
,所以硫酸的浓度是![]() =2.5mol/L,故D错误;
=2.5mol/L,故D错误;
答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断下列叙述不正确的
元素代号 | A | B | C | D | E | N | G |
原子半径 |
|
|
|
|
|
|
|
主要化合价 |
|
|
|
|
|
|
|
A.稳定性:HG>HN;熔沸点:HG>HN
B.工业上常用电解熔融DN3的方法冶炼D单质
C.B、C原子的最外层子电子数相同
D.![]() 的最高价氧化物的水化物溶液的pH:
的最高价氧化物的水化物溶液的pH:![]()