题目内容
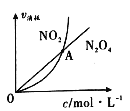
【题目】有关反应“H-+NH3 = H2 +![]() ”的说法正确的是
”的说法正确的是
A. 该反应属于置换反应 B. NH3是氧化剂
C. H-、NH3的总能量与H2、![]() 的总能量之差为该反应的活化能 D. 若反应中有lmol电子转移,则生成1gH2
的总能量之差为该反应的活化能 D. 若反应中有lmol电子转移,则生成1gH2
【答案】B
【解析】
A、反应H-+NH3=H2+NH2-是两种化合物之间的反应,不属于置换反应,故A错误;B、反应H-+NH3=H2+NH2-中,NH3中氢元素化合价降低,NH3是氧化剂,故B正确;C、H-、NH3的总能量与H2、NH2-的总能量之差为该反应的反应热,而不是活化能,故C错误;D、反应H-+NH3=H2+NH2-中,NH3中氢元素化合价降低,H-中氢元素化合价升高,NH3中氢元素化合价降低,转移电子1mol,生成氢气1mol,质量为2g,故D错误;故选B。

【题目】某小组同学为探究 H2O2、 H2SO3、 Br2 氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
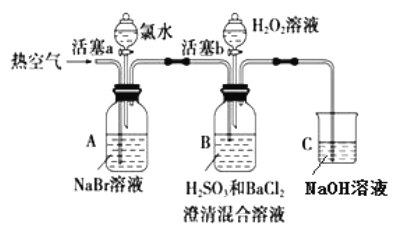
实验记录如下:
实验操作 | 实验现象 | |
① | 打开活塞 a,滴加氯水,关闭活塞 a | _____________________________________________ |
② | 吹入热空气一段时间后停止 | A中溶液颜色明显变浅;B中有气泡,产生大量白色沉淀,沉降后上层清液为无色 |
③ | 打开活塞b,逐滴加入H2O2溶液 | 开始时溶液颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成橙红色。 |
完成下列填空:
(1)在进行操作①时,A中的实验现象是___________,有关反应的离子方程式是___________。
(2)操作②吹入热空气的目的是____________。B 中产生白色沉淀的化学式是___________。
(3)装置C的作用是____________________。
(4)由上述实验可知,在此实验条件下,H2O2、H2SO3、Br2氧化性强弱顺序为________________。
(5)操作③开始时颜色无明显变化可能原因是(写出一条即可):___________________。