��Ŀ����
����Ŀ��ijС��ͬѧΪ̽�� H2O2�� H2SO3�� Br2 ������ǿ�����������ʵ�飨�г���������ȥ��װ�õ��������Ѽ��飩��
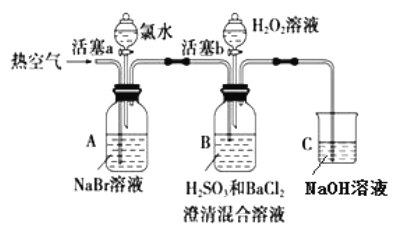
ʵ���¼���£�
ʵ����� | ʵ������ | |
�� | ���� a���μ���ˮ���رջ��� a | _____________________________________________ |
�� | �����ȿ���һ��ʱ���ֹͣ | A����Һ��ɫ���Ա�dz��B�������ݣ�����������ɫ�������������ϲ���ҺΪ��ɫ |
�� | ����b����μ���H2O2��Һ | ��ʼʱ��Һ��ɫ�����Ա仯�������μ�H2O2��Һ��һ��ʱ����Һ��ɳȺ�ɫ�� |
���������գ�
��1���ڽ��в�����ʱ��A�е�ʵ��������___________���йط�Ӧ�����ӷ���ʽ��___________��
��2�������ڴ����ȿ�����Ŀ����____________��B �в�����ɫ�����Ļ�ѧʽ��___________��
��3��װ��C��������____________________��
��4��������ʵ���֪���ڴ�ʵ�������£�H2O2��H2SO3��Br2������ǿ��˳��Ϊ________________��
��5�������ۿ�ʼʱ��ɫ�����Ա仯����ԭ���ǣ�д��һ�����ɣ���___________________��
���𰸡� A ����Һ��Ϊ�Ⱥ�ɫ Cl2+2Br-=Br2+2Cl- �������� Br2 BaSO4 ����β�� H2O2��Br2��H2SO3 H2SO3 ��ʣ�ࣨH2O2Ũ��С�� Br-�� H2O2 ��Ӧ�������أ��������ɣ�
��������װ�÷������������á��������������Դ������������һԭ�����Ƚ�H2O2��H2SO3��Br2������ǿ������NaBr��Һ�еμ���ˮ����ˮ�û����嵥�ʣ�Ȼ��Ĵ��ȿ�������Br2(g)����Bװ�ã�H2SO3��BaCl2����Ӧ����Br2(g)���룬�����˰�ɫ��������Br2��H2SO3������H2SO4��Br2����ԭΪBr-��˵��Br2������ǿ��H2SO3���ð�ɫ����ΪBaSO4������Bװ���м���H2O2��Һ��һ��ʱ�����Һ��Ⱥ�ɫ����Br-������ΪBr2��˵��H2O2�����Ա�Br2ǿ��
��1������ a����NaBr��Һ�еμ���ˮ����ˮ����������Ϊ�嵥�ʣ���Ӧ����ʽΪCl2+2Br-=Br2+2Cl-��A����Ϊ���嵥�ʵ���A����Һ��Ⱥ�ɫ��
�ʴ�Ϊ��A����Һ��Ϊ�Ⱥ�ɫ��Cl2+2Br-=Br2+2Cl-��
��2��Br2���лӷ��ԣ��ȿ����ܴٽ�Br2�ӷ�����Br2(g)����Bװ�ã�Br2��H2SO3����ΪH2SO4������ɫ����ΪBaSO4��
�ʴ�Ϊ����������Br2��BaSO4��
��3��װ��C��ΪNaOH��Һ����Ӧ������������������������Ⱦ�����岻���ŷŵ�������,������NaOH��Һ���գ�����װ��C������������β����
�ʴ�Ϊ������β����
��4������������������֪��������H2O2��Br2��H2SO3��
��5���������У���Bװ������μ���H2O2����Һ��ʼʱ��ɫ�����Ա仯��������Ϊ��Bװ���л���H2SO3ʣ�࣬H2O2����H2SO3��Ӧ������Br-��Ӧ��Ҳ��������ΪH2O2Ũ��С�� Br-��H2O2 ��Ӧ�������ء�

 �Ƹ�360�ȶ����ܾ�ϵ�д�
�Ƹ�360�ȶ����ܾ�ϵ�д� ���⿼����Ԫ���Ծ�ϵ�д�
���⿼����Ԫ���Ծ�ϵ�д� ��У���˳�̾�ϵ�д�
��У���˳�̾�ϵ�д� ��У���һ��ͨϵ�д�
��У���һ��ͨϵ�д�

