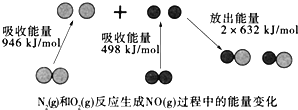
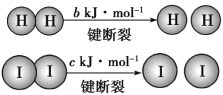
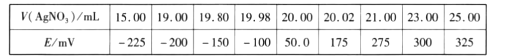
题目内容
【题目】X、Y、Z、W、R 是现在元素周期表中的短周期元素,原子序数依次增大。X原子核外各层电子数之比为 1:2,Y 原子和Z原子的外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为_____,元素Z的离子结构示意图为_____。
(2)单质铜和元素Y的最高价氧化物对应水化物的稀溶液发生反应的化学方程式为__。
(3)元素W非金属性比元素R弱,用原子结构的知识解释原因_____。
(4)R的一种氧化物能使品红溶液褪色,工业上用Y的气态氢化物的水溶液做其吸收剂,写出吸收剂与足量该氧化物反应的离子方程式_____。
(5)Y和Z组成的化合物 ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为_____________。
【答案】![]()
 8HNO3(稀)+3Cu=2NO↑+3Cu(NO3)2+4H2O P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱 SO2+NH3·H2O=HSO3-+NH4+ Al2O3+3C+N2
8HNO3(稀)+3Cu=2NO↑+3Cu(NO3)2+4H2O P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱 SO2+NH3·H2O=HSO3-+NH4+ Al2O3+3C+N2![]() 2AlN+3CO
2AlN+3CO
【解析】
X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1∶2,则为碳元素,Y的氧化物和R的氧化物均能形成酸雨,为二氧化氮和二氧化硫,则Y为氮元素,R为硫元素。Y原子和Z原子的核外电子数之和为20,Z为铝元素,W和R是同周期相邻元素,为磷元素,故X、Y、Z、W、R分别为C、N、Al、P、S,由此分析。
(1)X为碳元素,其最高价氧化物为二氧化碳,电子式为![]() ;Z为铝元素,离子结构示意图为
;Z为铝元素,离子结构示意图为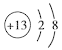 ;
;
(2)铜与氮元素的最高价氧化物对应的水化物的稀溶液即稀硝酸反应生成硝酸铜和一氧化氮和水,方程式为:8HNO3(稀)+3Cu=2NO↑+3Cu(NO3)2+4H2O;
(3)W为磷元素,在ⅤA族。因为P原子和S原子的电子层数相同,P原子半径较大,得电子能力较弱,故非金属性较弱;
(4)二氧化硫能使品红褪色,工业上用氨气吸收过量的二氧化硫,生成亚硫酸氢铵,故离子方程式为:SO2+NH3·H2O=HSO3-+NH4+;
(5)Z的氧化物为氧化铝,X为碳,Y为氮气,三者在高温下反应生成氮化铝,因为Z的氧化物和X单质的物质的量之比为1:3,所以产物为一氧化碳,方程式为:Al2O3+3C+N2![]() 2AlN+3CO。
2AlN+3CO。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案