题目内容
【题目】冬季我国北方大部分地区出现雾霾天气,引起雾霾的微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物、扬尘、重金属铜等。
(1)N元素原子核外电子云的形状有___________种;基态铜原子的价电子排布式为___________。
(2)N和O中第一电离能较小的元素是___________;SO42-的空间构型___________。
(3)雾霾中含有少量的水,组成水的氢元素和氧元素也能形成化合物H2O2,其中心原子的杂化轨道类型为_________,H2O2难溶于CC14,其原因为___________________。
(4)PM2.5富含NO,NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中心离子的配位数为________。
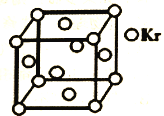
(5)测定大气中PM2.5浓度的方法之一是β-射线吸收法,β-射线放射源可用85Kr。已知Kr晶体的晶胞结构如图所示,设NA为阿伏伽德罗常数的值,晶胞边长为540pm,则该晶体的密度_____ g/cm3(只列式不计算,Kr摩尔质量为85g·mol—1)。
【答案】2 3d104s1 O 正四面体 sp3 H2O2 为极性分子,CCl4 为非极性溶剂,所以 H2O2 难溶于 CCl4 中 6 ![]()
【解析】
(1)N位于周期表中第2周期第ⅤA族,Cu位于周期表中第4周期第ⅠB族,据此分析解答;
(2)N的2p为半满结构,较为稳定,第一电离能反常;根据VSEPR理论判断SO42-的空间构型;
(3)H2O2中O形成两根共价键,自身含有两对孤电子对;根据相似相容原理分析解答H2O2难溶于CC14的原因;
(4)NO和H2O为单齿配体,据此分析配位数;
(5)根据均摊法确定一个晶胞中含有的粒子数目,由ρ=![]() 计算晶体密度。
计算晶体密度。
(1)N位于周期表中第2周期第ⅤA族,则N元素核外电子排布式为1s22s22p3,核外电子云形状有2种;Cu位于周期表中第4周期第ⅠB族,则其价电子排布式为3d104s1,故答案为:2;3d104s1;
(2)N的2p为半满结构,较为稳定,第一电离能较大,所以N和O中第一电离能较小的元素是O;对于SO42-,根据VSEPR理论,价层电子对数=4+![]() =4,则其空间构型为正四面体,故答案为:O;正四面体;
=4,则其空间构型为正四面体,故答案为:O;正四面体;
(3)H2O2中O形成两根共价键,自身含有两对孤电子对,所以O为sp3杂化;
H2O2分子中正负电荷中心不重合,为极性分子,CCl4为非极性分子,根据相似相容原理,极性分子难溶于非极性溶剂,所以H2O2难溶于CCl4,故答案为:sp3;H2O2为极性分子,CCl4为非极性溶剂,所以H2O2难溶于CCl4中;
(4)NO能被FeSO4溶液吸收生成配合物[Fe(NO)(H2O)5]SO4,该配合物中配体为NO和H2O,均为单齿配体,所以配位数为6,故答案为:6;
(5)1个晶胞中含有Kr原子数目为8×![]() +6×
+6×![]() =4个,1mol晶胞的质量为m=4×85g,1mol晶胞体积为V=(540×10-10)3NAcm3,则晶体密度为ρ=
=4个,1mol晶胞的质量为m=4×85g,1mol晶胞体积为V=(540×10-10)3NAcm3,则晶体密度为ρ=![]() =
=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

【题目】不同元素的原子在分子内吸引电子的能力大小可用一定数值x来表示,若x越大,其原子吸引电子的能力越强,在所形成的分子中成为负电荷一方。
下面是某些短周期元素的x值:
元素符号 | Li | Be | B | C | O | F | Na | Al | Si | P | S | Cl |
x值 | 0.98 | 1.57 | 2.04 | 2.55 | 3.44 | 3.98 | 0.93 | 1.61 | 1.90 | 2.19 | 2.58 | 3.16 |
(1)通过分析x值变化规律,确定Mg的x值范围:____<x(Mg)< _____。
(2)推测x值与原子半径的关系是____;根据短周期元素的x值变化特点,体现了元素性质的________变化规律。
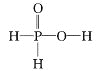
(3)某有机化合物结构式为![]() ,其中S—N中,你认为共用电子对偏向谁?__(写原子名称)。
,其中S—N中,你认为共用电子对偏向谁?__(写原子名称)。
(4)经验规律告诉我们:当成键的两原子相应元素的差值(Δx),当Δx>1.7时,一般为离子键,当Δx<1.7时,一般为共价键,试推断AlBr3中化学键类型是______。
(5)预测元素周期表中,x值最小的元素位置:_________
【题目】氟化铬可用作毛织品防蛀剂、卤化催化剂、大理石硬化及着色剂。以铬云母矿石(含4.5%Cr2O3,还含Fe2O3、FeO、MgO、SiO2)为原料制备氟化铬的工艺流程如图。
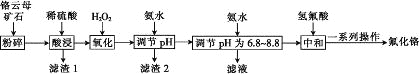
表中列出了相关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Mg(OH)2 | Cr(OH)3 | Fe(OH)2 |
开始沉淀的pH | 2.3 | 8.8 | 4.9 | 7.5 |
沉淀完全的pH | 4.1 | 10.4 | 6.8 | 9.7 |
请回答下列问题:
(1)Fe2O3、MgO、FeO、SiO2中属于碱性氧化物的有________种。
(2)将铬云母矿石粉碎的目的是________。
(3)滤渣1主要成分的用途是________。(写一种)
(4)Cr2O3与稀硫酸反应的化学方程式为___________。
(5)第一次滴加氨水调节pH范围为________。
(6)第二次滴加氨水调节pH为6.8~8.8的目的是_______,Cr(OH)3与 Al(OH)3一样具有两性,若第二次滴加的氨水改为NaOH溶液,生成的Cr(OH)3会部分溶解,写出Cr(OH)3溶解的离子方程式:________。
【题目】已知25 ℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10-5 |
| Ka=3.0×10-8 |
(1)物质的量浓度均为0.1 mol·L-1的下列四种溶液,pH由小到大排列的顺序是__________(用编号填写)。
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1 mol·L-1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是__________(填字母)。
a. ![]() b.
b. ![]() c.
c. ![]()
d. ![]() e.
e. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式__________。
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中:c(CH3COO-)-c(Na+)=__________(填准确数值)。
(5)25℃时,将a mol·L-1的醋酸与b mol·L-1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离常数为__________
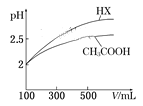
(6)体积均为100 mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数__________(填“>”、”=”或“<”)CH3COOH的电离平衡常数。