题目内容
【题目】常用小轿车(燃油汽车)中的动力和能量与化学反应息息相关。
(1)用C8H18代表汽油分子,写出汽油完全燃烧的化学方程式_____。
(2)关于汽油在气缸中燃烧反应的叙述正确的是_____
A.汽油具有的总能量高于生成物二氧化碳和水具有的总能量
B.汽油燃烧过程中,化学能转化为热能
C.断裂汽油和氧气分子中化学键吸收的能量小于生成碳氧化物和水中化学键放出的能量
D.汽车尾气中含NO的原因是汽油中含有氮元素,燃烧后生成NO
(3)汽车中的电瓶为铅酸电池,Pb+PbO2 +2H2SO4![]() PbSO4+2H2O,已知PbSO4难溶于水,下列说法正确的是_____
PbSO4+2H2O,已知PbSO4难溶于水,下列说法正确的是_____
A. 放电时,负极的电极反应式为:Pb-2e-=Pb2+
B.放电时,正极得电子的物质是PbO2
C.放电时,理论上每消耗20.7g铅,外电路中转移的电子为0.4mol
D.充电是使放电时的氧化还原反应逆向进行
(4)研究氢氧燃料电池中,H2所在的电极为_____极(填“正”或“负”),电极反应式为_______。
【答案】2C8H18+25O2![]() 16CO2+18H2O BC BD 负 H2-2e-+2OH-=2H2O
16CO2+18H2O BC BD 负 H2-2e-+2OH-=2H2O
【解析】
根据汽油的成分和辛烷的组成元素写出化学方程式,根据燃烧放热判断能量的变化。根据电极反应找到负极和正极材料,根据电极反应判断转移的电子数目。根据燃料电池的原理回答。
(1)C8H18完全燃烧生成CO2和H2O时反应的化学方程式为2C8H18+25O2![]() 16CO2+18H2O;
16CO2+18H2O;
(2)A.汽油燃烧是放热反应,则参加反应的汽油和氧气具有的总能量高于生成物二氧化碳和水具有的总能量,故A错误;
B.汽油燃烧过程中,能量转化形式为化学能转化为热能,故B正确;
C.汽油燃烧是放热反应,则断裂汽油和氧气分子中化学键吸收的能量小于生成碳氧化物和水中化学键放出的能量,故C正确;
D.汽油是碳氢化合物,不含有氮元素,汽车尾气中含NO的原因是空气中的氮气在高温下氧化为NO,故D错误;
答案为BC。
(3)A.放电时是原电池,Pb为负极,其电极反应式为:Pb-2e-+SO42-=PbSO4↓,故A错误;
B.放电时原电池,PbO2在正极上得电子发生还原反应,生成PbSO4,故B正确;
C.放电时,理论上每消耗20.7g(物质的量为0.1mol)铅,外电路中转移的电子为0.2mol,故C错误;
D.充电时电解池,发生的反应为放电时的氧化还原反应逆反应,故D正确;
答案为BD;
(4)氢氧燃料电池中,O2所在的极为正极,则H2所在的电极为负极,发生氧化反应,其电极反应式为H2-2e-+2OH-=2H2O;氢氧燃料电池相对其它电池,体现了能量转化效率高,无污染等优点。

【题目】在2L密闭容器中充入气体A和B,发生A(g)+B(g)C(g)+2D(g) ΔH,所得实验数据如表。下列说法不正确的是
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 300 | 0.40 | 0.10 | 0.090 |
② | 500 | 0.40 | 0.10 | 0.080 |
③ | 500 | 0.20 | 0.05 | a |
A.ΔH>0
B.500 ℃该反应的平衡常数K=0.16 mol·L-1
C.③中达到平衡时,A的转化率大于20%
D.5min末测得①中n(C)=0.050 mol,则0到5min内v(D)=0.02mol·L-1·min-1
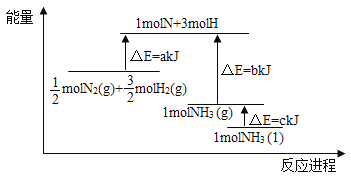
【题目】工业合成氨缓解了有限耕地与不断增长的人口对粮食大量需求之间的矛盾。
(1)N2分子通常条件下非常稳定,其本质原因是_____,工业上选择500℃主要出于两方面考虑,一是反应速率快;二是_____。
(2)将1mol气态分子断裂成气态原子所吸收的能量叫键能。相关键能数据如下表:
共价键 | H-H | N≡N | N-H |
键能(kJ/mol) | 436 | 946 | 391 |
结合表中所给信息,下图中能正确表示合成氨反应过程中能量变化关系的是_____。
(3)一定条件下,氨与水的反应存在限度,氨水成弱碱性,用一个化学用语,表示氨与水反应及溶液显碱性的原因_____。
(4)硫酸铵是一种固态氮肥,俗称“肥田粉”。硫酸铵可由氨与硫酸反应生成,硫酸铵中含有的化学键类型有_____。
(5)氨氧化法可以用来生产硝酸,写出第一步和第三步的化学反应方程式_________________、_________________。