题目内容
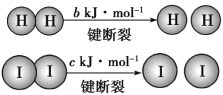
【题目】H2和I2在一定条件下能发生反应:已知(a、b、c 均大于零):H2(g)+I2(g)![]() 2HI(g) ΔH=-a kJ·mol-1。
2HI(g) ΔH=-a kJ·mol-1。
下列说法不正确的是( )
A.反应物的总能量高于生成物的总能量
B.断开1mol HH键和1 mol II键所需能量大于断开2 mol HI键所需能量
C.断开2mol HI键所需能量约为(c+b+a)kJ
D.向密闭容器中加入2molH2和2molI2,充分反应后放出的热量小于2akJ
【答案】B
【解析】
根据ΔH=反应物的总键能-生成物的总键能,结合题给信息,可知反应H2(g)+I2(g)![]() 2HI(g) ΔH=HH键键能+II键键能-2×HI键键能。据此进行分析。
2HI(g) ΔH=HH键键能+II键键能-2×HI键键能。据此进行分析。
A.由题给信息a>0,可知该反应的ΔH<0,根据ΔH=生成物的总能量-反应物的总能量,可知该反应反应物的总能量高于生成物的总能量,A项正确;
B.由题给信息,可知:HH键键能+II键键能-2×HI键键能<0,即断开1mol HH键和1 mol II键所需能量小于断开2 mol HI键所需能量,B项错误;
C.由分析可知,ΔH=HH键键能+II键键能-2×HI键键能,即:-a kJ·mol-1=b kJ·mol-1+c kJ·mol-1-2×HI键键能,则断开2mol HI键所需能量约为(c+b+a)kJ,C项正确;
D.该反应为可逆反应,物质不可能完全转化,故向密闭容器中加入2molH2和2molI2,充分反应后放出的热量小于2akJ,D项正确;
答案选B。

【题目】在2L密闭容器中充入气体A和B,发生A(g)+B(g)C(g)+2D(g) ΔH,所得实验数据如表。下列说法不正确的是
实验编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
n(A) | n(B) | n(C) | ||
① | 300 | 0.40 | 0.10 | 0.090 |
② | 500 | 0.40 | 0.10 | 0.080 |
③ | 500 | 0.20 | 0.05 | a |
A.ΔH>0
B.500 ℃该反应的平衡常数K=0.16 mol·L-1
C.③中达到平衡时,A的转化率大于20%
D.5min末测得①中n(C)=0.050 mol,则0到5min内v(D)=0.02mol·L-1·min-1