题目内容
5.关于CO2说法正确的是( )| A. | 碳原子采取sp杂化 | B. | CO2晶胞是体心结构 | ||
| C. | 干冰是原子晶体 | D. | CO2为极性分子 |
分析 A.二氧化碳分子中C原子价层电子对个数是2且不含孤电子对,为直线形分子;
B.CO2晶胞是面心结构;
C.干冰是二氧化碳分子构成的晶体;
D.正负电荷中心重合的分子为非极性分子,正负电荷中心不重合的分子为极性分子.
解答 解:A.二氧化碳分子中C原子价层电子对个数是2且不含孤电子对,为直线形分子,所以碳原子采取sp杂化,故A正确;
B.CO2晶胞是面心结构,故B错误;
C.干冰是二氧化碳分子构成的晶体,所以为分子晶体,故C错误;
D.二氧化碳分子结构式为O=C=O,为直线形分子,正负电荷中心重合,所以为非极性分子,故D错误;
故选A.
点评 本题以二氧化碳为载体考查分子空间构型、晶体类型、原子杂化方式及极性分子和非极性分子的判断,为高考高频点,难度不大.明确价层电子对互斥理论、晶体构成微粒与晶体类型的关系等即可解答.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
20.下列说法中,不符合ⅦA族元素性质特征的是( )
| A. | 易形成-1价离子 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下单质的氧化性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
14.镍镉可充电电池,电极材料是Cd和NiOOH,电解质是KOH,放电时的电极反应式:Cd+2OH--2e-═Cd(OH)2,2NiOOH+2H2O+2e-═2Ni(OH)2+2OH-.下列说法不正确的是( )
| A. | 电池的总反应式:Cd+2NiOOH+2H2O$?_{充电}^{放电}$2Ni(OH)2+Cd(OH)2 | |
| B. | 电池充电时,镉元素被还原 | |
| C. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| D. | 电池充电时,电池的负极和电源的正极连接 |
15.①pH=2的CH3COOH溶液;②pH=2的盐酸;③pH=12的氨水;④pH=12的NaOH溶液.相同条件下,有关上述溶液的比较中,正确的是( )
| A. | 水电离的c(H+):①=②=③=④ | |
| B. | 将②、③溶液混合后,pH=7,消耗溶液的体积:②<③ | |
| C. | 等体积的①、②、④溶液分别与足量铝粉反应,生成H2的量,②最大 | |
| D. | 向溶液中加入100 mL水后,溶液的pH:③>④>①>② |
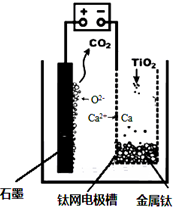 工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O