题目内容
8.用惰性电极电解一定浓度的硫酸铜溶液,一段时间后加入0.1摩尔的 Cu(OH)2恢复到电解前的状态,则:电解是如何进行的?写出电极反应式先是电解硫酸铜和水,再电解水,阳极:4OH--4e-=O2↑+2H2O,阴极:Cu2++2e-=Cu,2H++2e-=H2↑.分析 根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,则铜离子和氢氧根放电.
解答 解:Cu(OH)2从组成上可看成CuO•H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol H2SO4,并电解了0.1 molH2O,电解的总反应式:2H2O+2CuSO4$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4 ,即先是电解硫酸铜和水,再电解水,阳极上:4OH--4e-=O2↑+2H2O,电解时阴极上先是铜离子得电子生成铜,Cu2++2e-=Cu,后氢离子得电子生成氢气,2H++2e-=H2↑,
故答案为:先是电解硫酸铜和水,再电解水,阳极:4OH--4e-=O2↑+2H2O,阴极:Cu2++2e-=Cu,2H++2e-=H2↑.
点评 本题考查电解池的工作原理,先根据原子守恒计算析出铜单质的物质的量,再根据铜与转移电子之间的关系计算转移电子的物质的量.

练习册系列答案
相关题目
18.一下气体因与人体血液中的血红蛋白作用引起中毒的是( )
| A. | NO | B. | CO | C. | NO2 | D. | CO2 |
19.工业上电解饱和食盐水制氯气和实验室用MnO2与浓盐酸反应制氯气,相同的原理是( )
| A. | 都是将负价的氯转变为零价的氯 | B. | 都是将正价的氯转变为零价的氯 | ||
| C. | 都是复分解反应 | D. | 都是置换反应 |
3.金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是( )
| A. | BaCl2溶液 | B. | K2SO4溶液 | C. | CuSO4 | D. | NH4NO3溶液 |
20.下列说法中,不符合ⅦA族元素性质特征的是( )
| A. | 易形成-1价离子 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下单质的氧化性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
18.与OH-具有相同质子数和电子数的粒子是( )
| A. | F- | B. | NH3 | C. | H2O | D. | Na+ |
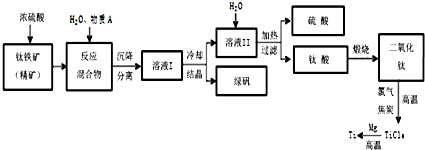
 工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
工业上生产金属钛的方法很多.以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如图,其中钛铁矿与浓硫酸发生反应的化学方程式为:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O