题目内容
9.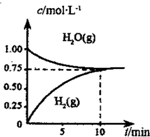 工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )
工业上制备合成气的工艺主要是水蒸气重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g)△H>0,在一定条件下,向体积为1L的密闭容器中充入1mol CH4(g)和1mol H2O(g),测得H2O(g)和H2(g)的浓度随时间变化曲线如图所示,下列说法正确的是( )| A. | 达平衡时,CH4(g)的转化率为75% | |
| B. | 0~10min内,v(CO)=0.075mol•L-1•min-1 | |
| C. | 该反应的化学平衡常数K=O.1875 | |
| D. | 当CH4(g)的消耗速率与H2(g)的消耗速率相等时,反应到达平衡 |
分析 由图可知,10min时反应到达平衡,利用三段式计算各物质浓度变化量、平衡时各物质的浓度.
A.甲烷转化率=$\frac{甲烷浓度变化量}{甲烷起始浓度}$×100%;
B.根据v=$\frac{△c}{△t}$计算v(CO);
C.将平衡时的浓度代入平衡常数表达式K=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$计算;
D.同一物质的消耗速率与其生成速率相等时,反应到达平衡.
解答 解:由图可知,10min时反应到达平衡,平衡时水、氢气的浓度均为0.75mol/L,则:
CH4(g)+H2O(g)?CO(g)+3H2(g)
开始(mol/L):1 1 0 0
转化(mol/L):0.25 0.25 0.25 0.75
平衡(mol/L):0.75 0.75 0.25 0.75
A.平衡时甲烷转化率=$\frac{0.25mol/L}{1mol/L}$×100%=25%,故A错误;
B.0~10min内,v(CO)=$\frac{0.25mol/L}{10min}$=0.025mol•L-1•min-1,故B错误;
C.平衡常数K=$\frac{c(CO)×{c}^{3}({H}_{2})}{c(C{H}_{4})×c({H}_{2}O)}$=$\frac{0.25×0.7{5}^{3}}{0.75×0.75}$=0.1875,故C正确;
D.同一物质的消耗速率与其生成速率相等时,反应到达平衡,由方程式可知但CH4(g)的消耗速率与H2(g)的消耗速率为1:3时,反应到达平衡,故D错误,
故选C.
点评 本题考查化学平衡、化学反应速率及化学平衡常数计算、平衡状态的判断,难度不大,D选项中注意同一物质的消耗速率与其生成速率相等时,反应到达平衡,不同物质表示的正逆速率之比等于其化学计量数之比时,反应到达平衡.

 阅读快车系列答案
阅读快车系列答案| A. | 都是将负价的氯转变为零价的氯 | B. | 都是将正价的氯转变为零价的氯 | ||
| C. | 都是复分解反应 | D. | 都是置换反应 |
| A. | 易形成-1价离子 | B. | 从上到下原子半径逐渐减小 | ||
| C. | 从上到下单质的氧化性逐渐减弱 | D. | 从上到下氢化物的稳定性依次减弱 |
| A. | 电池的总反应式:Cd+2NiOOH+2H2O$?_{充电}^{放电}$2Ni(OH)2+Cd(OH)2 | |
| B. | 电池充电时,镉元素被还原 | |
| C. | 电池放电时,电池负极周围溶液的pH不断增大 | |
| D. | 电池充电时,电池的负极和电源的正极连接 |
| A. | F- | B. | NH3 | C. | H2O | D. | Na+ |
| A. | 利用沸点数据可以推测将一些液体混合物分离开来的可能性 | |
| B. | 通过比较溶度积常数(Ksp)与溶液中有关离子浓度幂的乘积--离子积(Qc)的相对大小,可以判断难溶电解质在给定条件下能否生成或溶解 | |
| C. | 利用溶液的pH与7的大小关系,可以判断任何温度下溶液的酸碱性 | |
| D. | 根据分散质粒子直径的大小,可以判断分散系的类别 |