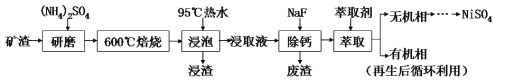
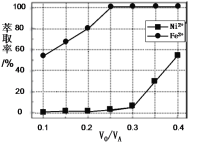
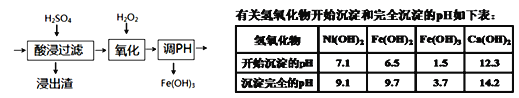
题目内容
【题目】已知汽车发动机工作时氮气与氧气转化为一氧化氮,能量变化关系如图所示,下列有关说法正确的是
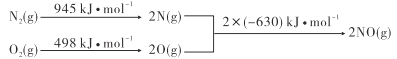
A.2NO(g)= N2(g)+O2(g)△H=+183kJ·mol-1
B.断裂1molN≡N键放出945kJ的能量
C.2molO(g)的总能量比1molO2(g)的多498kJ
D.N2(g)+O2(g)=2NO(g)的正反应活化能小于逆反应活化能
【答案】C
【解析】
A.根据图示,该反应中的反应热=反应物的键能和-生成物的键能和=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,为吸热反应,其热化学反应方程式为:N2(g)+O2(g)=2NO(g)△H=+183 kJmol-1,则2NO(g)=N2(g)+O2(g)△H=-183kJ·mol-1,故A错误;
B.断裂化学键需要吸收能量,根据图示,断裂1molN≡N键需要吸收945kJ的能量,故B错误;
C.根据图示,1molO2(g)断开化学键形成2molO(g)时需要吸收498kJ能量,说明生成物的总能量高于反应物的总能量,化学反应中的能量变化遵循能量守恒,即2molO(g)的总能量比1molO2(g)的多498kJ,故C正确;
D.根据A项分析,N2(g)+O2(g)=2NO(g)△H=+183 kJmol-1,为吸热反应,△H=正反应活化能-逆反应活化能>0,即正反应活化能大于逆反应活化能,故D错误;
答案选C。

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目