题目内容
【题目】从某矿渣(成分为NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等)中回收NiSO4的工艺流程如图:
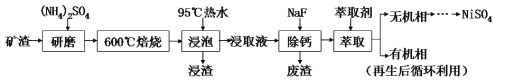
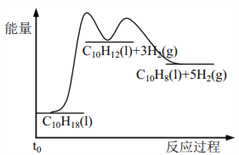
已知:(NH4)2SO4在350℃分解生成NH3和H2SO4;NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3。
回答下列问题:
(1)“研磨”的目的是___。
(2)矿渣中部分FeO在空气焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为____。
(3)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为___。“浸渣”的成分除Fe2O3、FeO(OH)、CaSO4外还含有___(填化学式)。
(4)向“浸取液”中加入NaF以除去溶液中Ca2+,溶液中c(F-)至少为___mol·L-1时,可使钙离子沉淀完全。[已知Ca2+浓度小于1.0×10-5mol·L-1时沉淀完全;Ksp(CaF2)=4.0×10-11]
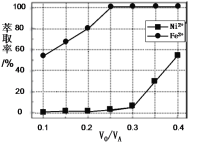
(5)萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相)![]() FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比(
FeR2(有机相)+2H+(水相)。萃取剂与溶液的体积比(![]() )对溶液中Ni2+、Fe2+的萃取率影响如图所示,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,![]() 的最佳值为___。在___(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
的最佳值为___。在___(填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
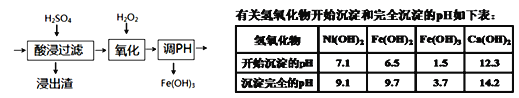
(6)若将流程图中浸泡步骤改为如图步骤(前后步骤不变)。依据下表数据判断,调pH范围为___。
【答案】增大接触面积,加快反应速率 4FeO+6H2SO4+O2![]() 2Fe2(SO4)3+6H2O Fe3++2H2O
2Fe2(SO4)3+6H2O Fe3++2H2O![]() FeO(OH)+3H+ SiO2 2.0×10-3 0.25 强酸性 3.7≤pH<7.1
FeO(OH)+3H+ SiO2 2.0×10-3 0.25 强酸性 3.7≤pH<7.1
【解析】
某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵研磨后,600°C焙烧,已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4;NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3,在90°C的热水中浸泡过滤得到浸出液,加入NaF除去钙离子,过滤得到滤液加入萃取剂得到无机相和有机相,无机相通过一系列操作得到硫酸镍,有机相循环使用,据此分析解答。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是增大接触面积,加快反应速率,使反应更充分;
(2)矿渣中部分FeO在空气焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为4FeO+6H2SO4+O2![]() 2Fe2(SO4)3+6H2O;
2Fe2(SO4)3+6H2O;
(3) “浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为:Fe3++2H2O![]() FeO(OH)+3H+;根据分析,浸渣”的成分除Fe2O3、FeO(OH) 、CaSO4外还含有SiO2;
FeO(OH)+3H+;根据分析,浸渣”的成分除Fe2O3、FeO(OH) 、CaSO4外还含有SiO2;
(4)向“浸取液”中加入NaF以除去溶液中Ca2+,已知Ca2+浓度小于1.0×10-5mol·L-1时沉淀完全,溶液中c(F)=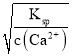 =
=![]() ≈2×103mol/L,故溶液中c(F-)至少为2×103 mol/L;
≈2×103mol/L,故溶液中c(F-)至少为2×103 mol/L;
(5)本工艺中,萃取剂与溶液的体积比(![]() )对溶液中Ni2+、Fe2+的萃取率影响如图所示,最佳取值是亚铁离子不能被萃取,镍离子被萃取,
)对溶液中Ni2+、Fe2+的萃取率影响如图所示,最佳取值是亚铁离子不能被萃取,镍离子被萃取,![]() 的最佳取值是0.25;由Fe2+(水相)+2RH(有机相)FeR(有机相)+2H+(水相)可知,加酸,增大氢离子的浓度,使平衡逆向移动,可生成有机相,则应在强酸性介质中“反萃取”能使有机相再生而循环利用;
的最佳取值是0.25;由Fe2+(水相)+2RH(有机相)FeR(有机相)+2H+(水相)可知,加酸,增大氢离子的浓度,使平衡逆向移动,可生成有机相,则应在强酸性介质中“反萃取”能使有机相再生而循环利用;
(6)若将流程图中浸泡步骤改为如图步骤(前后步骤不变),亚铁离子被双氧水氧化为铁离子,除杂过程中要将铁离子除去但不能使镍离子沉淀,依据下表数据判断,pH=3.7时铁离子完全沉淀,pH=7.1时镍离子开始沉淀,则调节pH范围为3.7≤pH<7.1。

 走进文言文系列答案
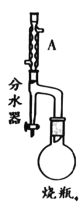
走进文言文系列答案【题目】实验室制备甲基丙烯酸甲酯的反应装置示意图和有关信息如下:
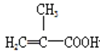 +CH3OH
+CH3OH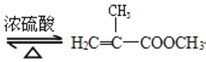 +H2O
+H2O
药品 | 相对分子质量 | 熔点/℃ | 沸点/℃ | 溶解性 | 密度(gcm-3) |
甲醇 | 32 | -98 | -64.5 | 与水混溶,易溶于有机溶剂 | 0.79 |
甲基丙烯酸 | 86 | 15 | 161 | 溶于热水,易溶于有机剂 | 1.01 |
甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有机溶剂 | 0.944 |
已知甲基丙烯酸甲酯受热易聚合;甲基丙烯酸甲酯在盐溶液中溶解度较小;CaCl2可与醇结合形成复合物;
实验步骤:
①向100mL烧瓶中依次加入:15mL甲基丙烯酸、2粒沸石、10mL无水甲醇、适量的浓硫酸;
②在分水器中预先加入水,使水面略低于分水器的支管口,通入冷凝水,缓慢加热 烧瓶。在反应过程中,通过分水器下部的旋塞分出生成的水,保持分水器中水层液面的高度不变,使油层尽量回到圆底烧瓶中;
③当 ,停止加热;
④冷却后用试剂 X 洗涤烧瓶中的混合溶液并分离;
⑤取有机层混合液蒸馏,得到较纯净的甲基丙烯酸甲酯。请回答下列问题:
(1)A装置的名称是_____。
(2)请将步骤③填完整____。
(3)上述实验可能生成的副产物结构简式为_____(填两种)。
(4)下列说法正确的是______
A.在该实验中,浓硫酸是催化剂和脱水剂
B.酯化反应中若生成的酯的密度比水大,不能用分水器提高反应物的转化率
C.洗涤剂X是一组试剂,产物要依次用饱和Na2CO3、饱和CaCl2溶液洗涤
D.为了提高蒸馏速度,最后一步蒸馏可采用减压蒸馏;该步骤一定不能用常压蒸馏
(5)实验结束收集分水器分离出的水,并测得质量为2.70g,计算甲基丙烯酸甲酯的产率约为_____。实验中甲基丙烯酸甲酯的实际产率总是小于此计算值,其原因不可能是_____。
A.分水器收集的水里含甲基丙烯酸甲酯
B.实验条件下发生副反应
C.产品精制时收集部分低沸点物质
D.产品在洗涤、蒸发过程中有损失
【题目】某学生对Na2SO3与AgNO3在不同pH下的反应进行探究。
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,原因是(用离子方程式表示):___。
(2)调节pH,实验记录如下:
实验序号 | pH | 实验现象 |
a | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
b | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
c | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
查阅资料得知:
ⅰ.Ag2SO3:白色,难溶于水,溶于过量的Na2SO3溶液。
ⅱ.Ag2O:棕黑色,不溶于水,能和酸反应。
该学生对产生的白色沉淀提出了两种假设:
①白色沉淀为Ag2SO3。
②白色沉淀为Ag2SO4,推测的依据是___。
(3)取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解。该同学设计实验确认了白色沉淀不是Ag2SO4。实验方法是:另取Ag2SO4固体置于__溶液中,未溶解。
(4)将c中X滤出、洗净,为确认其组成,实验如下:
Ⅰ.向X中滴加稀盐酸,无明显变化。
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体。
Ⅲ.分别用Ba(NO3)2、BaCl2溶液检验Ⅱ中反应后的溶液,前者无明显变化,后者产生白色沉淀。
①实验Ⅰ的目的是___。
②根据实验现象分析,X的成分是___。
③Ⅱ中反应的化学方程式是___。
(5)该同学综合以上实验,分析产生X的原因:随着酸性的增强,体系的还原性增强。