��Ŀ����
����Ŀ����һ�������£���ӦH2(g)+ I2(g) 2HI(g) ��H��0��һ�ܱ���ϵ�дﵽ��ѧƽ�⡣��448��ʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Ϊ49��
(1)��д���÷�Ӧ��ƽ�ⳣ���ı���ʽ__________��
(2)����˵������˵���÷�Ӧ�Ѵ�ƽ��״̬����______________(����ĸ������)
A.ѹǿ���ٸı�
B.����֮�� v(H2):v(I2):v(HI)=1:1:2
C.����������ɫ���ٸı�
D.���������ܶȲ��ٸı�
(3)ֻ�ı������������û�ѧƽ������ƶ�����������Ӧ�����ƶ��������淴Ӧ�����ƶ����۲��ƶ��������¶�__________��(�����������գ���ͬ)��С���������___________������������䣬ͨ������___________������ѹǿ���䣬ͨ�����____________��
���𰸡�K=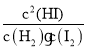 C �� �� �� ��
C �� �� �� ��
��������
(1)����ƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮��������д��
(2)���淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ��������䣬�Լ��ɴ������һϵ�����������䣬�ݴ˷������
(3)�����¶ȣ������ȷ�Ӧ�����ƶ�����С������������൱����ѹǿ������������䣬ͨ�����������ӷ�Ӧ���Ũ�ȣ�����ѹǿ���䣬ͨ�벻���뷴Ӧ�Ķ������壬��Ӱ��ƽ���ƶ���
(1)ƽ�ⳣ�������������Ũ����֮�����Է�Ӧ���Ũ����֮��������ƽ�ⳣ��K=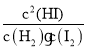 ��
��
(2)A����ӦH2(g)+ I2(g) 2HI(g)�Ƿ�Ӧǰ����������������ϵ����ϵ��ѹǿʼ�ձ��ָı䣬��A������Ϊ�жϷ�Ӧ�ﵽƽ������ݣ�
B�����۷�Ӧ�Ƿ�ﵽƽ�⣬��Ӧ����֮�ȶ����ڻ�ѧ����ʽ����ϵ���ȣ���B������Ϊ�жϷ�Ӧ�ﵽƽ������ݣ�
C����Ӧǰ����ɫ����Ӧ����ɫ��dz������ϵ��ɫ���ٱ仯����Ӧ�ﵽƽ�⣬��C����Ϊ�жϷ�Ӧ�ﵽƽ������ݣ�
D����ƽ����ϵ��ѭ�����غ㣬������������䣬��ƽ����ϵ�Ƿ�Ӧǰ����������������ϵ���������ʼ�ձ��ֲ��䣬����������ܶ�ʼ�ձ��ָı䣬��D������Ϊ�жϷ�Ӧ�ﵽƽ������ݣ�
��ѡC��
(3)�����������䣬ֻ�����¶ȣ�ƽ�������ȷ�Ӧ�����ƶ��������ƶ����ʴ�ѡ����
�����������䣬ֻ��С������������൱����ѹǿ����ƽ����ϵ�Ƿ�Ӧǰ����������������ϵ��ѹǿ��Ӱ��ƽ���ƶ�����ƽ�ⲻ�ƶ����ʴ�ѡ����
����������䣬ͨ�������������˷�Ӧ���Ũ�ȣ�ƽ�������ƶ����ʴ�ѡ����
����ѹǿ���䣬ͨ�벻���뷴Ӧ�����������ƽ�ⲻ�ƶ����ʴ�ѡ����

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�����Ŀ��ijѧ����Na2SO3��AgNO3�ڲ�ͬpH�µķ�Ӧ����̽����
��1�����Na2SO3��ҺpH��10��AgNO3��ҺpH��5��ԭ���ǣ������ӷ���ʽ��ʾ����___��
��2������pH��ʵ���¼���£�
ʵ����� | pH | ʵ������ |
a | 10 | ������ɫ�������Ժ��ܽ⣬��Һ���� |
b | 6 | ������ɫ������һ��ʱ�����δ�ܽ� |
c | 2 | ����������ɫ������һ��ʱ���������״�غ�ɫ����X |
�������ϵ�֪��
��.Ag2SO3����ɫ��������ˮ�����ڹ�����Na2SO3��Һ��
��.Ag2O���غ�ɫ��������ˮ���ܺ��ᷴӦ��
��ѧ���Բ����İ�ɫ������������ּ��裺
�ٰ�ɫ����ΪAg2SO3��
�ڰ�ɫ����ΪAg2SO4���Ʋ��������___��
��3��ȡb��c�а�ɫ����������Na2SO3��Һ�У������ܽ⡣��ͬѧ���ʵ��ȷ���˰�ɫ��������Ag2SO4��ʵ�鷽���ǣ���ȡAg2SO4��������__��Һ�У�δ�ܽ⡣
��4����c��X�˳���ϴ����Ϊȷ������ɣ�ʵ�����£�
��.��X�еμ�ϡ���ᣬ�����Ա仯��
��.��X�м������ŨHNO3����������ɫ���塣
��.�ֱ���Ba(NO3)2��BaCl2��Һ������з�Ӧ�����Һ��ǰ�������Ա仯�����߲�����ɫ������
��ʵ����Ŀ����___��
�ڸ���ʵ�����������X�ijɷ���___��
�ۢ��з�Ӧ�Ļ�ѧ����ʽ��___��
��5����ͬѧ�ۺ�����ʵ�飬��������X��ԭ���������Ե���ǿ����ϵ�Ļ�ԭ����ǿ��