题目内容
4.某气体样品可能由H2S、H2、Cl2、SO2、CO2和O2中的一种或几种组成,进行下列实验.已知试剂过量,反应完全,“→”表示气体流向.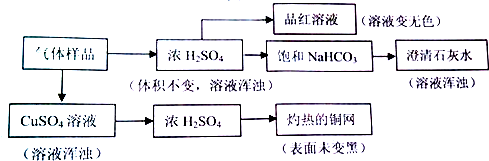
对上述实验结果,判断正确的是( )
| A. | 能使品红溶液褪色,说明原气体样品中至少含有Cl2或SO2 | |
| B. | 灼热的铜网未变黑,说明原气体样品中一定不含有O2 | |
| C. | 澄清石灰水变浑浊,说明原气体样品中含有SO2,不能确定是否含有CO2 | |
| D. | 经过硫酸铜溶液,溶液变浑浊,说明原气体样品中含有H2S,则可排除SO2、Cl2的存在 |
分析 气体样品经过硫酸铜溶液,溶液变浑浊,说明原气体样品中含有H2S,SO2、Cl2和硫化氢由于发生氧化还原反应而不能共存,故则可排除两者的存在,再通过灼热的铜网表面未变黑可能是原混合气体中同时有氢气和氧气,故不能证明氧气存在与否;
气体样品通过浓硫酸变浑浊,且通过浓硫酸的混合气能使品红溶液褪色,说明此过程生成S单质和二氧化硫气体,故通过饱和碳酸氢钠溶液,澄清石灰水变浑浊,不能证明原气体中存在二氧化碳气体;据此选择即可.
解答 解:气体样品经过硫酸铜溶液,溶液变浑浊,说明原气体样品中含有H2S,SO2、Cl2和硫化氢由于发生氧化还原反应而不能共存,故则可排除两者的存在,再通过灼热的铜网表面未变黑,可能是原混合气体中同时有氢气和氧气,故不能证明氧气存在与否;
气体样品通过浓硫酸变浑浊,且通过浓硫酸的混合气能使品红溶液褪色,说明此过程生成S单质和二氧化硫气体,故通过饱和碳酸氢钠溶液,澄清石灰水变浑浊,不能证明原气体中存在二氧化碳气体,
A、原溶液中不存在二氧化硫和氯气,存在硫化氢,硫化氢与浓硫酸反应生成二氧化硫致使品红褪色,故A错误;
B、原气体中可能同时存在氢气和氧气,不能说明原气体样品中一定不含有O2,故B错误;
C、原气体中不存在二氧化硫,澄清石灰水变浑浊,是浓硫酸与H2S反应生成的SO2,与饱和NaHCO3反应产生CO2,因此不能确定是否是原混合气体是否有CO2,故C错误;
D、经过硫酸铜溶液,溶液变浑浊,说明原气体样品中含有H2S,那么SO2、Cl2一定不存在,故D正确,故选D.
点评 本题主要考查的是常见气体的检验,通过浓硫酸得出生成二氧化硫气体和硫单质是解决本题的关键,难度较大.

练习册系列答案
相关题目
19.一面是某同学用化学知识解决生活中的问题,其中不合理的是( )
| A. | 用食醋除去暖水瓶中的水垢 | |
| B. | 用热的纯碱溶液洗涤餐具上的油 | |
| C. | 用米汤检验食盐中是否含碘酸钾 | |
| D. | 用灼烧并闻气味的方法区别纯棉和纯羊毛织物 |
9.已知某反应aA(g)+bB(g)═2C(g)的各物质浓度数据如表:
据此可推算出上述方程式中各物质的化学计量数之比是( )
| A | B | C | |
| 起始浓度(mol/L) | 3.0 | 1.0 | 0 |
| 2s末浓度(mol/L) | 1.8 | 0.6 | 0.8 |
| A. | 9:3:4 | B. | 3:1:2 | C. | 2:1:3 | D. | 3:2:1 |
16.四种短周期元素的性质或结构信息如下表,下列结论中错误的是( )
| 元素 | W | X | Y | Z |
| 性质或结构信息 | 单质制成的高压灯,发出的黄光透雾力强、射程远. | 工业上通过分离液态空气获得其单质.原子的最外层未达到稳定结构. | 单质常温常压下是气体,原子的M层差一个电子达稳定结构. | +2价阳离子的核外电子排布与氖原子相同. |
| A. | 上表中与W属于同一周期的元素是Z和Y | |
| B. | Z和Y形成的化合物属于离子化合物 | |
| C. | X的氢化物常温、常压下一定为液体 | |
| D. | Y单质为有色气体,具有强氧化性 |
13.已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br+2Na-→CH3CH2CH2CH3+2NaBr;应用这一反应,下列所给化合物中可以与钠合成环丁烷的是( )
| A. | CH3Br | B. | CH3CH2CH2CH2Br | C. | CH2BrCH2Br | D. | CH3CHBrCH2CH2Br |
14.下列说法中正确的是( )
| A. | 基态原子是处于最低能量状态的原子 | |
| B. | 基态C原子的电子排布式是1s22s12p3 | |
| C. | 焰色反应是金属原子的电子从基态跃迁到激发态时产生的光谱 | |
| D. | 同一原子处于激发态时的能量一定低于基态时的能量 |
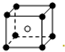
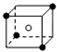
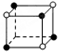
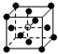
 和化学式中M分别代表阳离子,图中
和化学式中M分别代表阳离子,图中 和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )
和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )