题目内容
20.A、B、C、D、E、F六种短周期元素的原子序数依次增大.已知A、C、F三原子的最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水,D元素原子的最外层电子数比次外层电子数少4个,E元素原子的次外层电子数比最外层电子数多3个.试回答:(1)写出下列元素的符号ANa,DSi,EP;
(2)用电子式表示B、F形成的化合物
 ;
;(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式Al(OH)3+OH-═AlO2-+2H2O;
(4)D的固态氧化物是原子晶体.含n mol D的氧化物的晶体中含D-0共价键为4nmol.
分析 A、B、C、D、E、F六种短周期元素的原子序数依次增大,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;E元素原子次外层电子数比最外层电子数多3,E原子有3个电子层,最外层电子数为8-3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则E的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg,据此进行解答.
解答 解:A、B、C、D、E、F六种短周期元素的原子序数依次增大,D元素的最外层电子数比次外层电子数少4,D原子只能有3个电子层,原子最外层电子数为8-4=4,则D为Si元素;E元素原子次外层电子数比最外层电子数多3,E原子有3个电子层,最外层电子数为8-3=5,则E为磷元素;A、C、F三种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,则含有Al元素,氢氧化铝溶于强酸、强碱,故有Na元素,则A为Na、C为Al,三种原子最外层共有11个电子,则E的最外层电子数为11-1-3=7,则F为Cl元素,结合原子序数可知B为Mg,
(1)由上述分析可知,A为Na,D为Si,E为为P,
故答案为:Na;Si;P;
(2)B、F形成的化合物为氯化镁,用电子式表示其形成过程为 ,
,
故答案为: ;
;
(3)A、C两种元素最高价氧化物的水化物之间反应的离子方程式为:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(4)D为Si元素,其氧化物为二氧化硅,二氧化硅属于原子晶体;Si能形成4个共价键,nmol二氧化硅中含有nmolSi原子,所以nmol二氧化硅含4nmolSi-O键,
故答案为:原子;4n.
点评 本题考查结构性质位置关系、常用化学用语等知识,题目难度中等,注意基础知识的理解掌握,推断元素是解题的关键,明确原子结构与元素周期律、元素周期表的关系.

 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn 2++Cu | |
| B. | 氢氧化钠溶液与盐酸反应:OH-+H+═H2O | |
| C. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 氯化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4 |
| A. | c=$\frac{dS}{142(S+100)}$ mol•L-1 | B. | S=$\frac{142W}{180W+322Y}$g | ||
| C. | X=YS | D. | W=$\frac{3220X}{1420-18S}$g |
| A | B | C | |
| 起始浓度(mol/L) | 3.0 | 1.0 | 0 |
| 2s末浓度(mol/L) | 1.8 | 0.6 | 0.8 |
| A. | 9:3:4 | B. | 3:1:2 | C. | 2:1:3 | D. | 3:2:1 |
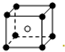
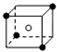
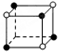
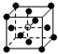
 和化学式中M分别代表阳离子,图中
和化学式中M分别代表阳离子,图中 和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )
和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )