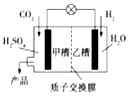
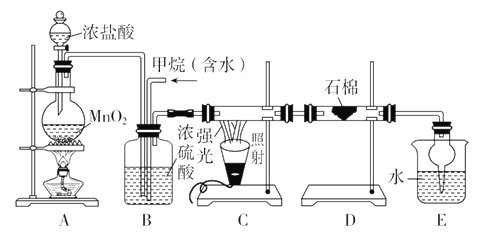
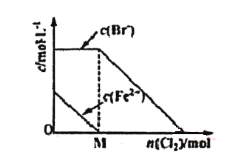
题目内容
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是
A. 0.1 mol·L-1 Na2CO3与0.l mol·L-1 NaHCO3溶液等体积混合:2/3 c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
B. 0.1 mol·L-1 Na2C2O4与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
C. 0.1 mol·L-1 CH3COONa与0.l mol·L-1 HCl 溶液等体积混合:c(Na+) = c(Cl-) > c(OH-) > c(CH3COO-)
D. 0.l mol·L-1 NH4Cl与0.l mol·L-1氨水等体积混合(pH > 7): c(NH3·H2O) > c(NH4+) > c(Cl-) > c(OH-)
【答案】A
【解析】0.1 mol·L-1 Na2CO3与0.l mol·L-1 NaHCO3溶液等体积混合,![]() ,根据物料守恒可知,c(CO32-) + c(HCO3-) + c(H2CO3)=0.1 mol·L-1,所以2/3 c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3),A正确;0.1 mol·L-1 Na2C2O4与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸),生成等量的草酸氢钠和氯化钠;根据电荷守恒:2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+);所以B错误;0.1 mol·L-1 CH3COONa与0.l mol·L-1 HCl 溶液等体积混合,生成等量的醋酸和氯化钠,溶液显酸性,c(Na+) = c(Cl-),c(CH3COO-) > c(OH-),C错误;根据电荷守恒:
,根据物料守恒可知,c(CO32-) + c(HCO3-) + c(H2CO3)=0.1 mol·L-1,所以2/3 c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3),A正确;0.1 mol·L-1 Na2C2O4与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸),生成等量的草酸氢钠和氯化钠;根据电荷守恒:2c(C2O42-)+c(HC2O4-)+c(OH-)+c(Cl-)=c(Na+)+c(H+);所以B错误;0.1 mol·L-1 CH3COONa与0.l mol·L-1 HCl 溶液等体积混合,生成等量的醋酸和氯化钠,溶液显酸性,c(Na+) = c(Cl-),c(CH3COO-) > c(OH-),C错误;根据电荷守恒:![]() ,混合溶液为碱性,故
,混合溶液为碱性,故![]() ,故
,故![]() ,溶液呈碱性,说明电离大于水解,则
,溶液呈碱性,说明电离大于水解,则![]() ,故离子关系为
,故离子关系为![]() ,D错误;正确选项A。
,D错误;正确选项A。

【题目】减少氮氧化物和硫氧化物在大气 中的共放是环境保护的重要内容之一。
(1).已知:N2(g)+O2(g)=2NO (g) △H=+180.5kJ/mol
C(s )+ O2(g)=CO2(g) △H =-393.5kJ/mo1
2C(s)+ O2(g) =2CO(g) △H=-221kJ/mol
若某反应平衡常数表达式为: k=[c(N2)·c2(CO2)]/[c2(NO)·c2(CO)],请写出此反应的热化学方式________________________。
(2)N2O4在一定条件下可发生分解: 2 N2O5(g)![]() 4NO2(g) +O2 (g)。某温度下测得恒容密闭容器中N2O4浓度随时间的变化如下表:
4NO2(g) +O2 (g)。某温度下测得恒容密闭容器中N2O4浓度随时间的变化如下表:
t /min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N0)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为P0第3.00min时体系压强为P1,则P1:P0 =__________2.00min~5.00min 内,O2的平均反应速率为________________。
②一定温度下,在恒容密闭容器充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________。
a.容器中压强不再变化 b.NO2和O2 的体积比保持不变
c.2V正( NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2.且保持不变
(3)活性炭还原NO2的反应为: 2NO2(g)+2C (s)![]() N2(g)+2CO2(g),在恒温条件下,1mo1NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质量浓度与平衡总压的关系如图所示:①A、B、C 三点中NO2的转化率最高约是_____点(填“A”、“B”或“C”)。
N2(g)+2CO2(g),在恒温条件下,1mo1NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质量浓度与平衡总压的关系如图所示:①A、B、C 三点中NO2的转化率最高约是_____点(填“A”、“B”或“C”)。

②计算C点时该反应的压强平衡常数Kp=_________MPa (K用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)直接排放含SO2的烟气会形成酸雨,危害环境。可月NaOH吸收,所得含硫各微粒(H2SO3 、HSO3-利SO32- )存在于反应后的溶被中,它们的物质量分数X(i)与溶液pH的关系如图所示。
若是与0.lmol/LNaOH 反应后的溶液,现得溶液为pH=8时,溶液中各离子浓度由大到小的顺序是____________________。
(5)实验狈得NH4HSO3溶液中,![]() ,则溶液的pH为_____;向该溶液中加氨水使溶液呈中性时,
,则溶液的pH为_____;向该溶液中加氨水使溶液呈中性时,![]() =______________。(已知: H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
=______________。(已知: H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。