题目内容
【题目】减少氮氧化物和硫氧化物在大气 中的共放是环境保护的重要内容之一。
(1).已知:N2(g)+O2(g)=2NO (g) △H=+180.5kJ/mol
C(s )+ O2(g)=CO2(g) △H =-393.5kJ/mo1
2C(s)+ O2(g) =2CO(g) △H=-221kJ/mol
若某反应平衡常数表达式为: k=[c(N2)·c2(CO2)]/[c2(NO)·c2(CO)],请写出此反应的热化学方式________________________。
(2)N2O4在一定条件下可发生分解: 2 N2O5(g)![]() 4NO2(g) +O2 (g)。某温度下测得恒容密闭容器中N2O4浓度随时间的变化如下表:
4NO2(g) +O2 (g)。某温度下测得恒容密闭容器中N2O4浓度随时间的变化如下表:
t /min | 0.00 | 1.00 | 2.00 | 3.00 | 4.00 | 5.00 |
c(N0)/(mol/L) | 1.00 | 0.71 | 0.50 | 0.35 | 0.25 | 0.17 |
①反应开始时体系压强为P0第3.00min时体系压强为P1,则P1:P0 =__________2.00min~5.00min 内,O2的平均反应速率为________________。
②一定温度下,在恒容密闭容器充入一定量N2O5进行该反应,能判断反应已达到化学平衡状态的是________。
a.容器中压强不再变化 b.NO2和O2 的体积比保持不变
c.2V正( NO2)=v逆(N2O5) d.气体的平均相对分子质量为43.2.且保持不变
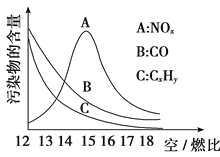
(3)活性炭还原NO2的反应为: 2NO2(g)+2C (s)![]() N2(g)+2CO2(g),在恒温条件下,1mo1NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质量浓度与平衡总压的关系如图所示:①A、B、C 三点中NO2的转化率最高约是_____点(填“A”、“B”或“C”)。
N2(g)+2CO2(g),在恒温条件下,1mo1NO2和足量活性炭发生该反应,测得平衡时NO2和CO2的物质量浓度与平衡总压的关系如图所示:①A、B、C 三点中NO2的转化率最高约是_____点(填“A”、“B”或“C”)。
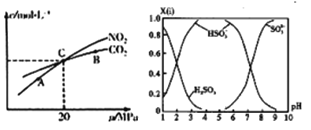
②计算C点时该反应的压强平衡常数Kp=_________MPa (K用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(4)直接排放含SO2的烟气会形成酸雨,危害环境。可月NaOH吸收,所得含硫各微粒(H2SO3 、HSO3-利SO32- )存在于反应后的溶被中,它们的物质量分数X(i)与溶液pH的关系如图所示。
若是与0.lmol/LNaOH 反应后的溶液,现得溶液为pH=8时,溶液中各离子浓度由大到小的顺序是____________________。
(5)实验狈得NH4HSO3溶液中,![]() ,则溶液的pH为_____;向该溶液中加氨水使溶液呈中性时,
,则溶液的pH为_____;向该溶液中加氨水使溶液呈中性时,![]() =______________。(已知: H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
=______________。(已知: H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
【答案】 2NO(g)+ 2CO(g)![]() N2(g)+2CO2(g) △H=-746.5kJ/mol 1.975:1 0.055mol/(L·min) a A 4 c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) >c(H+) 5 3
N2(g)+2CO2(g) △H=-746.5kJ/mol 1.975:1 0.055mol/(L·min) a A 4 c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) >c(H+) 5 3
【解析】(1).反应物及化学计量数为:2NO,2CO生成物及化学计量数为:N2,2CO2;反应热化学方程式为:2NO(g)+ 2CO(g)![]() N2(g)+2CO2(g),△H =2△H2-△H3-△H1=-746.5kJ/mol;
N2(g)+2CO2(g),△H =2△H2-△H3-△H1=-746.5kJ/mol;
(2). ①设容器体积为1L,则初始N2O4的量为1mol,3min后N2O4为0.35mol,生成NO21.3mol,O2为0.325mol,则P1:P0=n1:n0=1.975:1;2min时c(O2)=0.25 mol/L, 5min时c(O2)=0.415 mol/L,所以v(O2)=0.0.165/3 mol/(L·min)=0.055 mol/(L·min);②a.由于方程两端气体体积不同,所以当容器中压强不再发生变化时,反应达到平衡,a正确;b.两者体积比为定值,b错误;c.应该为:V正(NO2)=2v逆(N2O5) ,c错误;d. 气体的平均相对分子质量保持不变,反应平衡,但平均相对分子质量不一定为43.2,d错误。故选择a。
(3). ①容器内压强变大,有利于逆反应进行,所以压强最小的A点NO2的转化率最高;②设反应平衡时NO2消耗xmol,则此时容器中气体的物质的量为NO2(1-xmol),N2(x/2mol),CO2(xmol),由C点c(NO2)= c(CO2)得x=1/2,所以Kp=20*0.25/1.25 MPa =4 MPa;
(4). pH=8时,根据图示得到溶液为烟硫酸钠和亚硫酸氢钠的混合物,c(SO32-)>c(HSO3-),所以各离子浓度由大到小的顺序为c(Na+)>c(SO32-)>c(HSO3-)>c(OH-) >c(H+);
(5).![]() ,
,![]() ,Ka1·Ka2=15·c2(H+)=1.5×10-9,得出c(H+)=1.0×10-5mol/L,则pH=5;根据电荷守恒得c(NH4+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),由溶液pH=7得c(H+)= c(OH-),则c(NH4+)=2c(SO32-)+c(HSO3-),由
,Ka1·Ka2=15·c2(H+)=1.5×10-9,得出c(H+)=1.0×10-5mol/L,则pH=5;根据电荷守恒得c(NH4+)+ c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),由溶液pH=7得c(H+)= c(OH-),则c(NH4+)=2c(SO32-)+c(HSO3-),由![]() 得
得![]() 。
。

【题目】下列各组物质之间通过一步就能实现如图所示转化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
① |
| Na2O | Na2O2 | Na | NaOH |
② | Al2O3 | NaAlO2 | Al | Al(OH)3 | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | Si | SiO2 | Na2SiO3 | H2SiO3 |
A. ①② B. ②③ C. ②④ D. ①③
【题目】下列离子方程式的书写及评价均合理的是( )
选项 | 离子方程式 | 评价 |
A | 将2 mol Cl2通入含1 mol FeI2的溶液中: 2Fe2++2I-+2Cl2===2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | Ba(HCO3)2溶液与足量的NaOH溶液反应: Ba2++HCO3-+OH-===BaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
C | 过量SO2通入NaClO溶液中: SO2+H2O+ClO-===HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | 1 mol/L的NaAlO2溶液和2.5 mol/L的HCl溶液等体积混合: 2AlO2-+5H+===Al3++Al(OH)3↓+H2O | 正确;第一步反应和第二步反应消耗的H+的物质的量之比为2∶3 |
A. A B. B C. C D. D