题目内容
19.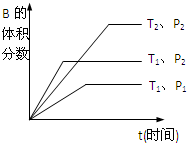 (1)已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空
(1)已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空①化学计量数的关系:m+n<q;(填“>”.“<”或“=”)
②该反应的正反应为吸热反应.(填“吸热”或“放热”)
(2)在FeCl3+3KSCN?Fe(SCN)3+3KCl的平衡体系中,回答下列问题:(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡正向移动.
②在溶液中加入少量的KCl固体,平衡不移动.
分析 (1)根据“先拐先平,数值大”原则,采取定一议二得到温度和压强的大小关系,根据图示,结合压强和B的含量的关系判断方程式前后的系数和大小关系,根据温度和B的含量的关系,确定化学反应的吸放热情况;
(2)根据平衡移动原理分析,改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动;
①加入少量KSCN固体,反应中SCN-浓度增大;
②根据实际参加反应的离子浓度分析,加入少量KCl固体,溶液中Fe3+、SCN-浓度不变.
解答 解:(1)定压强相同,比较温度不同时,即比较曲线T1、P2与曲线T2、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的温度高,所以T1>T2,定温度相同,比较压强不同时,即比较曲线T1、P1与曲线T1、P2,根据先出现拐点,先到达平衡,先出现拐点的曲线表示的压强高,所以P1<P2,
①压强P1<P2,由图知压强越大,B的含量越高,所以平衡向逆反应进行,增大压强,平衡向体积减小的方向移动,所以m+n<q,故答案为:<;
②温度T1>T2,由图知温度越高,B的含量越低,所以平衡向正反应进行,升高温度,平衡向吸热方向移动,故正反应为吸热反应,故答案为:吸热;
(2)①加入少量KSCN固体,反应中SCN-浓度增大,平衡向正向移动;
故答案为:正向;
②加入少量KCl固体,溶液中Fe3+、SCN-浓度不变,K+和Cl-不参加反应,平衡不移动;
故答案为:不.
点评 本题考查外界条件对化学反应速率、化学平衡移动影响、学生识图能力,题目难度不大,做题时注意分析图象曲线的变化特点,根据“先拐先平,数值大”原则,采取定一议二解答.

练习册系列答案
相关题目
9.某元素的原子最外层有2个电子,关于该元素的推断一定正确的是( )
| A. | 是金属元素 | B. | 是IIA族元素 | C. | 是非金属元素 | D. | 无法确定 |
14.配制250mL 0.0500mol•L-1的Na2CO3溶液,不需要的仪器有( )
| A. | 锥形瓶 | B. | 250 mL容量瓶 | C. | 烧杯 | D. | 玻璃棒 |
11.实验室制取二氧化碳用不到的仪器是( )
| A. | 长颈漏斗 | B. | 广口瓶 | C. | 酒精灯 | D. | 集气瓶 |
 纯过氧化氢是淡蓝色的黏稠液体,可任意比例与水混合,是一种强氧化剂,水溶液俗称双氧水,为无色透明液体.其水溶液适用于医用伤口消毒及环境消毒和食品消毒.
纯过氧化氢是淡蓝色的黏稠液体,可任意比例与水混合,是一种强氧化剂,水溶液俗称双氧水,为无色透明液体.其水溶液适用于医用伤口消毒及环境消毒和食品消毒. .
.
 50mL 0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程所放出的热量可计算中和热,回答下列问题:
50mL 0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程所放出的热量可计算中和热,回答下列问题: