题目内容
8.分析下列反应:3S+6KOH═2K2S+K2SO3+3H2O,据此作答:(1)用双线桥标出该反应中电子的转移方向和数目:3S+6KOH═2K2S+K2SO3+3H2O
(2)该反应的还原产物是K2S.
(3)该反应的还原剂与氧化剂的质量比是1:2.
(4)当消耗 3molS时,则转移的电子数是4NA.
分析 (1)在3S+6KOH═2K2S+K2SO3+3H2O中,只有硫元素的化合价发生了变化,部分S由0价降为-2价,部分S由0价升为+4价,结合电子守恒可通过双线桥分析此氧化还原反应;
(2)还原产物是元素化合价降低被还原的产物;
(3)反应中硫元素的化合既升高又降低,硫既是氧化产物又是还原产物;
(4)若参加反应的硫是3mol时,只要搞清被氧化与被还原的硫的物质的量就可计算出转移电子数.
解答 解:(1)在3S+6KOH═2K2S+K2SO3+3H2O中,硫元素的化合价既升高又降低,其中有2个硫得4个电子化合价降为-2价,还原产物K2S,1个硫失4个电子,被氧化为K2SO3,可通过双线桥分析此反应: ,故答案为:
,故答案为: ;
;
(2)K2S是硫得电子被还原得到的产物,故答案为:K2S;
(3)硫的化合价既升高又降低,硫既是氧化产物又是还原产物,其中有2个硫是得电子是氧化剂,1个硫是失电子是还原剂,可知还原剂与氧化剂的物质的量之比是1:2,质量比也是1:2,故答案为:1:2;
(4)若3mol硫完全反应,1molS为还原剂,则反应中共转移电子1mol×(4-0)=4mol=4NA,故答案为:4NA.
点评 本题考查学生熟练运用氧化还原的理论分析氧化还原反应,涉及电子转移及双线桥分析,属基础题.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
16.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.8 g 一氧化碳和乙烯的混合气体中所含的碳原子数目为0.1NA | |
| B. | 标准状况下5.6 L N2O 气体所含的电子数为5.5NA | |
| C. | 用惰性电极电解CuCl2溶液阴极得到0.1NA 个Cu 原子时,阳极生成2.24 L 气体 | |
| D. | 0.1 mol•L-1 的NaCl 溶液中,Na+与Cl-的总数目为0.2NA |
3.下列各组中的离子,能在溶液中大量共存的是( )
| A. | Cu2+、Ba2+、Cl-、SO42- | B. | Na+、Fe3+、SO42-、OH- | ||
| C. | H+、Na+、CO32-、NO3- | D. | K+、Na+、Cl-、OH- |
20.一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,而不影响生成H2的总量,可向其中加入适量的( )
| A. | Na2CO3晶体 | B. | NaOH晶体 | C. | CuSO4溶液 | D. | CH3COONa晶体 |
17.下列实验操作中错误的是( )
| A. | 分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口 | |
| C. | 用加热、蒸发的方法可以除去NaCl中CaCl2、MgCl2等杂质 | |
| D. | 两种互不相溶,密度也不相同的液体可以用分液漏斗分离,例如苯和水 |
18.V、W、X、Y均是元素周期表中短周期元素,在周期表中的相对位置关系如表所示:其中X为常见的金属元素,另有Z为第四周期常见元素,该元素是人体血液中血红蛋白最重要的组成金属元素.V的最简单氢化物为甲,W的最简单氢化物为乙,甲、乙混合时有白烟生成.下列说法正确的是( )
| Y | V | |||
| X | W |
| A. | 少量Z的单质与过量W的单质可化合生成ZW2 | |
| B. | 甲、乙反应的生成物为离子晶体,但其中含有共价键 | |
| C. | 电负性大小关系是:X>Y>V>W | |
| D. | 甲中的V原子杂化类型是sp2 |
 图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,下层为四氯化碳,上层溶液为盐溶液,呈中性,请根据图示回答下列问题:
图甲池和乙池中的四个电极都是惰性材料,乙池溶液分层,下层为四氯化碳,上层溶液为盐溶液,呈中性,请根据图示回答下列问题: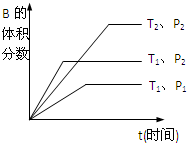 (1)已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空
(1)已知某可逆反应mA(g)+nB(g)?qC(g)在密闭容器中进行.如图所示反应在不同时间t,温度T和压强P与反应物B的体积分数的关系曲线.根据图象填空