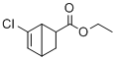
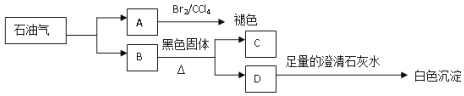
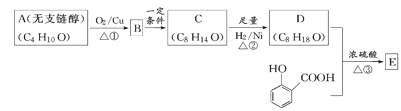
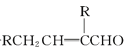��Ŀ����
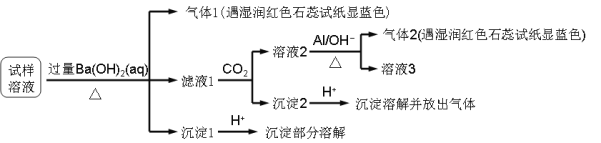
����Ŀ��ʵ�����ú������ʣ�FeO��Fe2O3���ķ�CuO�Ʊ��������壬���������й��̣���֪ Fe3+�� pH=5ʱ������ȫ�������з����������
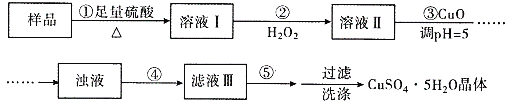
A. ����ڷ�������Ҫ��ӦΪ��2Fe2++H2O2+2H+=2Fe3++2H2O
B. ����ڲ�������ˮ�������ǿ����������H2O2
C. �����Ϊ���ˣ�����������ᾧ
D. ������� CuCO3����CuOҲ�ɵ�����Һ��pH
���𰸡�C
��������
A. �����Ϊ������������������������ԭ��Ӧ�����ӷ�ӦΪ2Fe2++H2O2+2H+=2Fe3++2H2O����A��ȷ��
B. �����������ˮ�������ǿ����������H2O2���������������ӡ���������ӵȣ����Գ�ȥ��ͬʱ������NO���壬���Բ���ڲ�������ˮ�������ǿ����������H2O2����B��ȷ��
C. �����Ϊ���ˣ�����ͭ��Һ������ͭ���岽��Ӧ��Ϊ����Ũ������ȴ�ᾧ�����������ᾧ�����Բ���������ᾧ����C����
D. CuCO3��CuO������Һ��H+��Ӧ��������ҺpH�����ã����������µ����ʣ���D��ȷ��

 �Ķ��쳵ϵ�д�
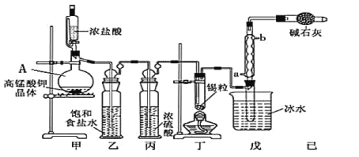
�Ķ��쳵ϵ�д�����Ŀ���������ǵ�ƹ�ҵ�ز����ٵĻ���ԭ�ϡ��Ӳ���ַ���(��Ҫ��Fe 42.35%��Cr 9.67%��Ni 5.1%��C 4.7%��Si 3.39%��)����ȡ����������Ĺ����������£�

��֪����Cr3+�백ˮ��Ӧʱ������Cr3+����[Cr(NH3)6]3+��������ʱ��������ֽ⡣Ni2+�백ˮ��Ӧ����[Ni(NH3)6]2+������������ʱ�ȶ����������ữʱ������Ӧ�������Ρ�
��Na2CrO4��Һ�м������pHΪ3.5ʱ��CrO42��ת��ΪCr2O72����
����������ڲ�ͬ�¶�ʱ�ܽ�����±���
�¶��ܽ��/g���� | 20�� | 30�� | 40�� | 60�� | 80�� | 90�� |
Na2SO4 | 19.5 | 40.8 | 48.8 | 45.3 | 43.7 | 42.7 |
Na2Cr2O7 | 183 | 198 | 215 | 269 | 376 | 405 |
(1)���������õ�����Һ����Ҫ����FeSO4��NiSO4��Cr2(SO4)3������NiSO4�Ļ�ѧ����ʽΪ_____���������ʱ������¶�Ϊ90�����ң����Բ��õļ��ȷ�ʽ��_____��
(2)��������ǰ���ʵ����ȵ�Ŀ����_____��
(3)�������������õ���������ϴ�ӣ�����������ϴ�Ӹɾ��ķ�����_____��
(4)��������ʱ�����������������Ʊ�Na2Cr2O7���塣
���������������Na2CO3����ڿ�������������Na2CrO4��CO2���˷�Ӧ�Ļ�ѧ����ʽΪ_____��
���벹�������������պ������Ʊ�Na2Cr2O7����(�Ⱥ�ɫ)��ʵ�鷽����ˮ�������ˣ�_____����Na2Cr2O7����(����ʹ�õ��Լ��У����ᣬ����ˮ)��
����Ŀ����A��B��C��D��E����Ԫ�ء��������Ϣ���£�
Ԫ�� | �����Ϣ |
A | Aԭ�ӵ�1s�����ֻ��1������ |
B | B�ǵ縺������Ԫ�� |
C | C�Ļ�̬ԭ��2p�����������δ�ɶԵ��� |
D | D������Ԫ������Eͬ���ڣ��������ܲ����������˶�״̬��ͬ�ĵ��� |
E | E���γɺ�ɫ(��ש��ɫ)��E2O�ͺ�ɫ��EO���������� |
��ش��������⣺
(1)д��EԪ��ԭ�ӻ�̬ʱ�ĵ����Ų�ʽ_______��
(2)CԪ�صĵ�һ�����ܱ���Ԫ�صĵ�һ������_____(������������С��)��
(3)CA3������Cԭ�ӵ��ӻ����������______��CA3���ӵĿռ乹����_____��
(5)A��C��E����Ԫ�ؿ��γ�[E(CA3)4]2�������ӣ����д��ڵĻ�ѧ��������________(�����)��
����λ�� �ڽ����� �ۼ��Թ��ۼ� �ܷǼ��Թ��ۼ� �����Ӽ� �����
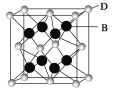
(5)B��D���γ����ӻ�����侧���ṹ��ͼ��ʾ������D���ӵ���λ��Ϊ_______��