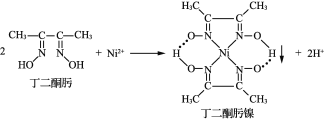
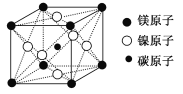
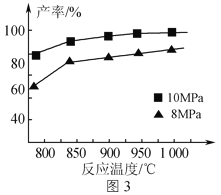
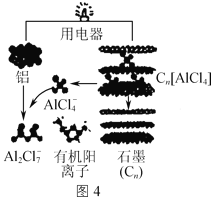
��Ŀ����
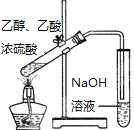
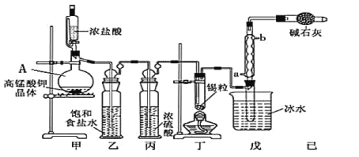
����Ŀ�����Ȼ���������ýȾ����������ͼ��ʾװ�ÿ����Ʊ����Ȼ���(���ּг�װ����ȥ)��
�й���Ϣ���±�

�ش��������⣺
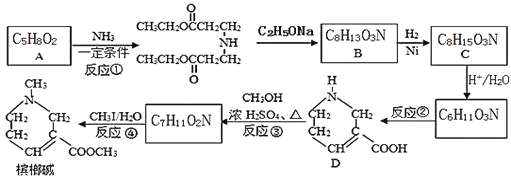
(1)��װ��������A������Ϊ_________��
(2)�ü�װ����������MnO4-����ԭΪMn2+���÷�Ӧ�����ӷ���ʽΪ_____________��
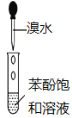
(3)��װ����ͼ���Ӻã���������ԣ���������Ũ���ᣬ���۲쵽______��������ʼ���ȶ�װ�ã����ۻ����ʵ����������������������ȶ�װ�ã���ʱ�������ȶ�װ�õ�Ŀ���ǣ� �ٴٽ�����������Ӧ�� ��_________��
(4)��װ�õ����� __________�����ȱ����װ�ã����ܷ����ĸ���Ӧ�Ļ�ѧ����ʽΪ___________����װ�õ�������__________������ţ�
A.��ֹ������CO2���������װ��
B.��ȥδ��Ӧ����������ֹ��Ⱦ����
C.��ֹˮ����������װ�õ��Թ���ʹ����ˮ��
D.��ֹ������O2������װ�õ��Թ���ʹ��������
(5)��Ӧ����ȥ����1.19g����Ӧ������װ�õ��Թ����ռ���2.04g SnCl4����SnCl4�IJ���Ϊ________��������2λ��Ч���֣�
���𰸡�������ƿ 2MnO4-+16H++10Cl-=2Mn2++5Cl2��+8H2O ��װ���ڳ�������ɫ���� ʹSnCl4���������ڴӻ�����з������ ��ȥ�����е��Ȼ��� Sn+2HCl=SnCl2+H2�� BC 78%
��������
�ڼ�װ�����ø�����ؾ�����Ũ���ᷴӦ��ȡ������ͨ����װ�ó�ȥ�����л��е�HCl���ʣ�Ȼ���ڱ�װ���и����������ڶ�װ����Cl2��Sn��Ӧ��ȡSnCl4��SnCl4����ˮ�⣬Ӧ����ˮ�����½��н��У���Ӧ����SnCl4Ϊ��̬�����촦�����ռ��õ�Һ̬SnCl4��������м�ʯ������δ��Ӧ����������ֹ��Ⱦ������ͬʱ���տ����е�ˮ��������ֹ�����ռ�SnCl4���Թ�ʹ��ˮ�⣬�Դ˽����⡣
(1)������װ��ͼ��֪AΪ������ƿ��
(2)A�з�����Ӧ��2KMnO4+16HCl(Ũ)=2KCl+2MnCl2+5Cl2��+8H2O�����ӷ���ʽΪ2MnO4-+16H++10Cl-=2Mn2++5Cl2��+8H2O��
(3)������װ���г�������ʱ������װ�ó�������ɫ���壬�ټ����ۻ������ϳ�SnCl4�����ȶ�װ�ã��ٽ�����������Ӧ��ʹ���ɵ�SnCl4�����������ڴӻ�����з���������������촦��ȴ�ռ���
(4)��װ�õ������dz�ȥCl2�е�����HCl���壬���ȱ����װ�ã����ܲ����ĺ���ǣ�HCl��Sn��Ӧ������Sn+2HCl=SnCl2+H2��������SnCl4���ʽ��ͣ���������������Ӧ���ܷ�����ը����װ����װ�м�ʯ�ң��������ǣ�����δ��Ӧ����������ֹ��Ⱦ������ͬʱ���տ����е�ˮ��������ֹ�����ռ�SnCl4���Թ�ʹ��ˮ�⣬��ѡ����������BC��
(5)��Ӧ����Sn��������1.19g�������ʵ���n(Sn)=![]() =0.01mol������Snԭ���غ㣬����������SnCl4���ʵ���Ϊ0.01mol����SnCl4�IJ���Ϊ
=0.01mol������Snԭ���غ㣬����������SnCl4���ʵ���Ϊ0.01mol����SnCl4�IJ���Ϊ![]() =78%��
=78%��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ����ѧʵ�������ƻ�������������ܿ�����Ԥ�ڵ��������й���ʵ������ķ�������ȷ���ǣ� ��
ѡ�� | A | B | C | D |
װ�� |
|
|
|
|
���� | ��Ͳ��δ������״Һ�� | �Թ����к�ɫ��������δ�������� | �Թ���δ������ɫ���� | NaOH��ҺҺ���� δ������״Һ�� |
ԭ�� | ����������δ��Ӧ | ��Ӧδ���ɵ����� | ����Ũ�� �ϴ� | ����ˮ�� |
A. AB. BC. CD. D