题目内容
【题目】信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为-96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶。
(1)铬(24号元素) 基态原子的电子排布式为___________。
(2)CH3COCH3分子中含有________个π键,含有____________个σ键。
(3)固态氯化铬酰属于______________晶体,丙酮中碳原子的杂化方式为______________,二硫化碳属于______________(填“极性”或“非极性”)分子,分子中含有____________(填“极性”或“非极性”)键。
(4)K[Cr(C2O4)2(H2O)2]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有____________键。
(5)金属铬的晶胞如图所示,一个晶胞中含有_______个铬原子。

【答案】1s22s22p63s23p63d54s1(或[Ar]3d54s1) 1 9 分子 甲基碳原子sp3、羰基碳原子sp2 非极性 极性 配位 2
【解析】
(1)铬为24号元素,属于第4周期第ⅥB族,其基态原子的电子排布式为1s22s22p63s23p63d54s1(或[Ar]3d54s1),所以本题答案:1s22s22p63s23p63d54s1(或[Ar]3d54s1);
(2)CH3COCH3分子结构式为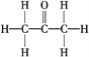 ,羰基中含有1个π键,分子中含有2个C—C σ键、6个C—H σ键、1个C—O σ键,共9个σ键,所以本题答案:1;9;
,羰基中含有1个π键,分子中含有2个C—C σ键、6个C—H σ键、1个C—O σ键,共9个σ键,所以本题答案:1;9;
(3)通过氯化铬酰常温下的熔沸点、溶解性可知其属于分子晶体;丙酮中含有两种碳原子,甲基碳原子杂化方式与甲烷碳原子相同,为sp3杂化,羰基碳原子为sp2杂化;二硫化碳为直线型分子,结构对称,属于非极性分子,其分子中只含极性键,所以本题答案:分子;甲基碳原子sp3、羰基碳原子sp2;非极性 ; 极性;
(4)K[Cr(C2O4)2(H2O)2]是配位化合物,其中肯定含有配位键,所以本题答案:配位;
(5)晶胞中显示的是9个原子,但8个位于晶胞顶点,每个顶点上的原子属于8个晶胞,故属于该晶胞的只有1/8;晶胞内的原子完全属于该晶胞,因此一个晶胞中含有2个铬原子,所以本题答案:2。

 名校课堂系列答案
名校课堂系列答案【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 实验结论 |
A | 向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入银氨溶液,水浴加热后未出现银镜 | 蔗糖未水解 |
B | 卤代烃Y与NaOH乙醇溶液共热后,加入足量稀硝酸,再滴加AgNO3溶液,产生白色沉淀 | 说明卤代烃Y中含有氯原子 |
C | 向浑浊的苯酚试液中加饱和Na2CO3溶液,试液变澄清且无气体产生 | 说明苯酚的酸性强于碳酸 |
D | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊 | 蛋白质发生了盐析 |
A. A B. B C. C D. D