题目内容
【题目】某化学实验小组的同学为了证明、比较SO2和氯水的漂白性,设计了如图所示的实验装置。
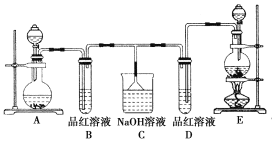
(1)实验室常选用KMnO4和浓盐酸制Cl2;选用Cu和浓硫酸反应制取SO2时,其中制SO2应选用如图A、E两发生装置中___装置(填装置序号),反应的化学方程式为___。
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管加热,两个试管中的现象分别为B:___,D:___。
(3)甲乙两名同学分别利用如图所示装置探究两种气体按不同比例混合后的漂白性。

试
①在气体进入品红溶液之前,先将SO2和Cl2通过盛有浓硫酸装置的目的是:___。
②甲同学在实验过程中发现:通气一段时间后,品红溶液几乎不褪色,其原因是:___(结合反应方程式)。
【答案】E Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O 无变化 恢复红色 控制气体通入速率,使二氧化硫和氯气充分混合 SO2和Cl2按1:1混合时,二者恰好完全反应,生成H2SO4和HCl,使混合气体失去漂白性,其反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl
CuSO4+SO2↑+2H2O 无变化 恢复红色 控制气体通入速率,使二氧化硫和氯气充分混合 SO2和Cl2按1:1混合时,二者恰好完全反应,生成H2SO4和HCl,使混合气体失去漂白性,其反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl
【解析】
(1)制取SO2所用药品是Cu单质和浓硫酸,反应条件加热,所以制取SO2应选用固液加热型装置,选E,其化学反应方程式为:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O,故答案为:E;Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,故答案为:E;Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)次氯酸的漂白性是利用次氯酸的强氧化性,二氧化硫的漂白性是利用二氧化硫和有色物质化合生成无色物质,次氯酸的漂白性是永久性的,二氧化硫的漂白性是暂时的;加热时,次氯酸漂白过的溶液无变化,二氧化硫和有色物质化合生成的无色物质不稳定,加热时能重新变成红色,所以停止通气后,B试管的品红溶液无变化,D试管的品红溶液恢复红色,故答案为:无变化,恢复红色。
(3)①浓硫酸和二氧化硫、氯气不反应,但氯气和二氧化硫在该装置中能充分混合,且通过观察气泡的速度控制气体流量,使二者充分混合,故答案为:控制气体通入速率,使二氧化硫和氯气充分混合。
②氯气有强氧化性,二氧化硫有还原性,二者按1:1发生氧化还原反应,失去漂白性,反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl,故答案为:SO2和Cl2按1:1混合时,恰好完全反应,生成H2SO4和HCl,使混合气体失去漂白性,反应方程式为:SO2+Cl2+2H2O=H2SO4+2HCl。

 优学名师名题系列答案
优学名师名题系列答案【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ |
请按要求回答下列问题。
(1)元素④的名称是______,元素④在周期表中所处位置___________,从元素原子得失电子的角度看,元素④具有____________(填“氧化性”或“还原性”)。
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:_____________________(写氢化物的化学式)。
(3)元素⑦的原子结构示意图是____________。
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式________________,这一反应是___________(填“吸热”或“放热”)反应。
(5)用电子式表示①与⑨反应得到的化合物的形成过程_______________________。