题目内容
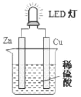
【题目】如下图为氢氧燃料电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。回答下列问题。
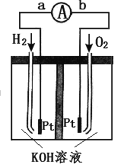
(1)氢氧燃料电池的能量转化主要形式是_______________________________;导线中电子流动方向为______________________(用a、b表示)。
(2)负极反应式_______________________________________________________。
(3)电极表面镀铂粉的原因____________________________________________。
(4)KOH溶液pH的变化___________(填“变大”“变小”或“不变”)。
(5)关于氢氧燃料电池,下列说法不正确的是___________。
①燃料电池的能量转化可达100%
②是一种不需要将还原剂和氧化剂全部贮存在电池内的新型发电装置
③氢氧燃料电池组合成燃料电池发电站,被人们誉为“绿色”发电站
④如果电池使用酸性电解质,负极反应式为:H2-2e-=2H+
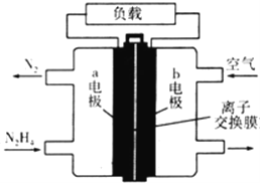
(6)如果以N2 和H2 为反应物,以溶有A的稀盐酸为电解质溶液,可研发出既能提供电能又能固氮的新型电池,装置如下图所示。
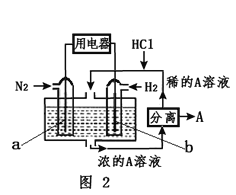
①指出该电池的正极___________(用a、b表示)。
②物质A的化学式____________________。
【答案】由化学能转变为电能 由a到b H2-2e-+OH-= 2H2O 增大电极单位面积吸附H2、O2分子数,加快电极反应速率 变小 ① a NH4Cl
【解析】
根据原电池和电解池的工作原理,电极方程式的书写及与氧化还原反应的关系分析解答。
(1) 氢氧燃料电池的工作原理属于原电池原理,是将化学能转化为电能的装置,在原电池中,电子从负极流向正极,而通入燃料氢气的电极是负极,通氧气的电极是正极,所以电子从a到b;
故答案为:化学能转化为电能;从a到b;
(2)a为负极,在KOH做电解质溶液的条件下,H2在负极失去电子,电极方程式为:H2-2e-+2OH-= 2H2O;
故答案为:H2-2e-+2OH-= 2H2O;
(3) 根据题目信息:“电池电极表面镀一层细小的铂粉,吸附气体的 能力强,性质稳定”,可知电极表面镀铂粉的原因为增大电极单位面积吸附H2、O2分子数,加快电极反应速率,保证气体充分参与电极反应;
故答案为:增大电极单位面积吸附H2、O2分子数,加快电极反应速率;
(4)由于反应中,不断的生成水,相当于将KOH溶液稀释,c(OH-)减小,PH变小;
故答案为:变小;
(5) ①氢氧燃料电池放电时,只有一部分能量转化为电能,所以能量转化率不是100%,故①错误;
②氢氧燃料电池中正负极的反应物质从外部储存装置通入,是一种不需要将还原剂和氧化剂全部储藏电池内的新型发电装置,故②正确;
③燃料电池的能量转化率超过80%,远高于普通燃烧过程,有利于节约能源。燃料电池还可组合成燃料电池发电站,这较人们誉为“绿色”发电站,它的优点主要表现在它不仅有巨大的经济优势,而且排放的度弃物也比普通火力发电站少得多,运行时噪音也低,因此此类电池具有广阔的发展前景,故③正确;
④如果电池使用酸性电解质,负极反应式为:H2-2e-=2H+,正极反应为:O2-4e-+4H+=2H2O,故④正确;
故答案为:①;
(6) 根据图示,该装置是以N2 和H2 为反应物形成的燃料电池,N2得到电子发生还原反应作正极,即a为正极,电极方程式为:N2+6e-+8H+=2NH4++H2,H2失去电子发生氧化反应,作负极,即b为负极,电极方程式为:H2-2e-=2H+;根据电极反应方程式得到总反应方程式为:N2+3H2+2H+=2NH4+,则A物质为NH4Cl;
故答案为:正极,NH4Cl;

【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
1 | ① | |||||||
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ |
请按要求回答下列问题。
(1)元素④的名称是______,元素④在周期表中所处位置___________,从元素原子得失电子的角度看,元素④具有____________(填“氧化性”或“还原性”)。
(2)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:_____________________(写氢化物的化学式)。
(3)元素⑦的原子结构示意图是____________。
(4)写出元素⑤形成的单质在氧气中燃烧的化学方程式________________,这一反应是___________(填“吸热”或“放热”)反应。
(5)用电子式表示①与⑨反应得到的化合物的形成过程_______________________。