题目内容
【题目】某校化学小组学生利用下图所列装置进行 “铁与水反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)
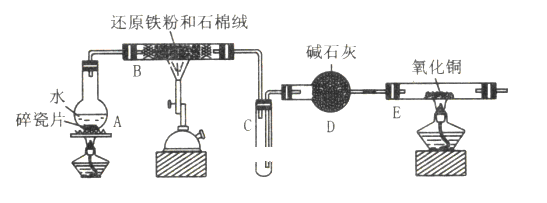
(1)装置B中发生反应的化学方程式是_________________________________________
(2)装置E中的现象是:_____________________________________________________
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。简述检验滤液中 Fe3+的操作方法:____________________________________________________________________
(4)该小组学生利用上述滤液制取FeCl3·6H2O晶体,设计流程如下:
![]()
步骤I中通入Cl2的作用是____________________________
该流程中需保持盐酸过量,主要原因是(结合离子方程式简要说明)
________________________________________________________________
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2黑色固体变为红色,管壁有水珠取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色将滤液中含有的Fe2+氧化成Fe3+FeCI3会发生水解反应,即3Fe3++3H2OFe(OH)3+3H+,过量盐酸能抑制FeCl3的水解
Fe3O4+4H2黑色固体变为红色,管壁有水珠取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色将滤液中含有的Fe2+氧化成Fe3+FeCI3会发生水解反应,即3Fe3++3H2OFe(OH)3+3H+,过量盐酸能抑制FeCl3的水解
【解析】
(1)装置B中铁粉和水蒸气在高温下发生反应生成四氧化三铁和氢气,方程式为 3Fe+4H2O(g)![]() Fe3O4+4H2 ;(2)装置B中铁和水蒸气反应生成氢气,经碱石灰干燥后加入装置E,氧化铜和氢气加热发生反应生成铜和水,所以反应的现象为:黑色固体变为红色,管壁有水珠; (3)检验铁离子用硫氰化钾溶液,观察是否变红,所以答案为:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色; (4)因为氯气具有氧化性,能将滤液中含有的Fe2+氧化成Fe3+ ;FeCl3会发生水解反应,即3Fe3++3H2OFe(OH)3+3H+,所以应在酸溶液中加热浓缩,主要是抑制铁离子的水解,故保持盐酸过量。
Fe3O4+4H2 ;(2)装置B中铁和水蒸气反应生成氢气,经碱石灰干燥后加入装置E,氧化铜和氢气加热发生反应生成铜和水,所以反应的现象为:黑色固体变为红色,管壁有水珠; (3)检验铁离子用硫氰化钾溶液,观察是否变红,所以答案为:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色; (4)因为氯气具有氧化性,能将滤液中含有的Fe2+氧化成Fe3+ ;FeCl3会发生水解反应,即3Fe3++3H2OFe(OH)3+3H+,所以应在酸溶液中加热浓缩,主要是抑制铁离子的水解,故保持盐酸过量。

【题目】亚硫酸盐是一种常见食品添加剂。为检测某食品中亚硫酸盐含量(通常以1 kg样品中含SO2的质量计),某研究小组设计了如下两种实验流程:
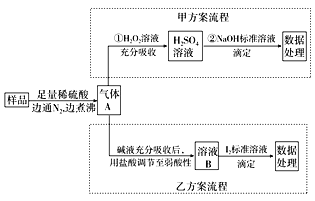
(1)甲方案第①步利用了H2O2的______性,H2O2是二元弱酸,写出H2O2电离方程式________________________
(2)甲方案第②步选酚酞做指示剂进行滴定,应选择图中________滴定管(填标号)。滴定时边滴边摇动锥形瓶,眼睛应观察________。

A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是__________________________________________
(3)写出乙方案滴定时的离子方程式:___________________________________。
(4)按乙方案若取样品20g配成100mL溶液,滴定消耗0.01000 mol·L-1 I2溶液的体积如表所示:
滴定次数 | 待测溶液 体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 20.00 | 1.02 | 21.03 |
2 | 20.00 | 2.00 | 25.00 |
3 | 20.00 | 0.60 | 20.59 |
滴定中误差较大的是第________次实验,造成这种误差的可能原因是________。
A.滴定管在装液前未用标准溶液润洗2~3次
B.滴定开始前滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
C.滴定开始前滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
D.达到滴定终点时,仰视溶液凹液面最低点读数
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
则1 kg样品中含SO2的质量是________g。



