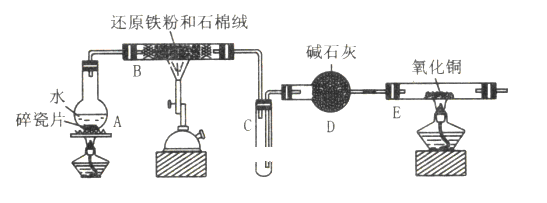
题目内容
【题目】(1)在下列反应中,水作氧化剂的是________。
A.Cl2+H2O![]() HCl+HClO B.NaH+H2O=NaOH+H2↑
HCl+HClO B.NaH+H2O=NaOH+H2↑
C.3Fe+4H2O(g)![]() Fe3O4 + 4H2 D. H2+CuO
Fe3O4 + 4H2 D. H2+CuO![]() H2O+Cu
H2O+Cu
E. 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)用双桥表示3Cl2+6KOH=5KCl+KClO3+3H2O电子转移的方和数目:__________________。
(3)在一定条件下,利用置换反应X+Y=W+Z,可实现物质之间的转化
①若X为Mg,W为C,则Z为__________________。
②若X为SiO2,W为CO,该反应在工业的用途是___________________。
(4) 某未知溶液中可能含有Fe2+,确定含该离子的实验方案为:取少量该溶液于试管中,先__________________,再__________________,则说明溶液中含有Fe2+。
【答案】BCE 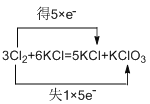 MgO 制备粗硅 滴加几滴KSCN溶液,无明显现象 加入氯水(或H2O2或稀硝酸等,合理均可),溶液变成血红色
MgO 制备粗硅 滴加几滴KSCN溶液,无明显现象 加入氯水(或H2O2或稀硝酸等,合理均可),溶液变成血红色
【解析】
(1)氧化剂在氧化还原反应中被还原,相关元素化合价降低,A.反应前后H2O中元素化合价不变;B.NaH中H的化合价为-1价,反应结束后化合价升高为0价,而H2O反应结束后H由+1价降低为0价,H2O被还原,作氧化剂;C.Fe由0价上升至+2、+3价,H2O中H由+1价降低为0价,H2O被还原,作氧化剂;D.H2O作氧化产物;E.H2O中H由+1价降低为0价,H2O被还原,作氧化剂;故答案为:BCE;
(2)由方程式可知,Cl化合价由0价升高为+5价,同时由0价降低为-1价,根据方程式可知,失去的电子数为:1×5e-,得到的电子数为:5×e-,故用双桥表示3Cl2+6KOH=5KCl+KClO3+3H2O电子转移的方和数目为: ;
;
(3)①由题可知,该反应是置换反应,若X为Mg,W为C,则发生的反应为:Mg+CO2![]() MgO+C,由此可知,Z为MgO;
MgO+C,由此可知,Z为MgO;
②若X为SiO2,W为CO,则发生的反应是:2C+SiO2![]() Si(粗硅)+2CO
Si(粗硅)+2CO![]() ,该反应在工业上的用途是制备粗硅;
,该反应在工业上的用途是制备粗硅;
(4)未知溶液中可能含有Fe2+,可将其氧化为Fe3+,再进行检验,同时要排除溶液中Fe3+的干扰,由此实验操作为:取少量该溶液于试管中,先滴加几滴KSCN溶液,无明显现象,加入氯水(或H2O2或稀硝酸等,合理均可),溶液变成血红色,则说明溶液中含有Fe2+。