题目内容
7.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.下列说法不正确的是( )| A. | 1 mol N2(g)和3 mol H2(g)的能量之和高于2 mol NH3 (g)的能量 | |
| B. | 形成2 mol NH3(g)的化学键释放的总能量大于断裂1 mol N2 (g) 和3 mol H2 (g) 的化学键所吸收的总能量 | |
| C. | 加入催化剂是为了加大反应速率,缩短生产周期,降低生产成本 | |
| D. | 将1 mol N2(g)和3 mol H2(g)充入一密闭容器中充分反应,放出92.2 kJ 的热量 |
分析 A、反应是放热反应,依据能量守恒分析判断;
B、反应是放热反应,依据能量守恒分析判断;
C、催化剂改变反应速率不改变化学平衡;
D、反应是可逆反应不能进行彻底.
解答 解:A、已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol.反应是放热反应,依据能量守恒,反应物总能量大于生成物总能量,1 mol N2(g)和3 mol H2(g)的能量之和高于2 mol NH3 (g)的能量,故A正确;
B、反应是放热反应,断裂化学键吸收能量,形成化学键放出能量,依据能量守恒,形成2mol NH3(g)的化学键释放的总能量大于断裂1mol N2(g)和3mol H2(g)的化学键所吸收的总能量,故B正确;
C、加入催化剂是为了加大反应速率,缩短达到平衡所需时间,降低生产成本,故C正确;
D、反应是可逆反应不能进行彻底;将1 mol N2(g) 和3 mol H2(g) 充入一密闭容器中反应,放出的热量小于92.4 kJ,故D错误;
故选D.
点评 本题考查了热化学方程式的应用,反应能量变化的分析判断,催化剂的作用,理解焓变含义,可逆反应的分析是解题关键,题目较简单.

练习册系列答案
相关题目
16.下列说法正确的是( )
| A. | Al2O3硬度高,熔点2054℃,沸点2980℃,属于原子晶体 | |
| B. | 在晶体中,只要有阴离子一定有阳离子 | |
| C. | 某固态单质能导电,该单质一定属于金属晶体 | |
| D. | SiO2分子中每个Si原子周围有4个O原子,每个O原子周围有2个Si原子 |
15.如图为反应2H2(g)+O2(g)═2H2O(g) 的能量变化示意图.下列说法正确的是( )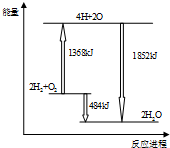

| A. | 拆开2mol H2(g)和1mol O2(g)中的化学键成为H、O原子,共放出1368kJ能量 | |
| B. | 由H、O原子形成2mol H2O(g),共吸收1852 kJ能量 | |
| C. | 2molH2(g)和1mol O2(g) 反应生成2mol H2O(l),共吸收484kJ能量 | |
| D. | 2molH2(g)和1mol O2(g)反应生成2mol H2O(g),共放出484kJ能量 |
2.用括号中的试剂和方法除去各物质中的杂质,正确的是( )
| A. | 甲烷中的乙烯(酸性高锰酸钾溶液,洗气) | |
| B. | 溴苯中的溴(水,分液) | |
| C. | 乙烯中的SO2(溴水,洗气) | |
| D. | 乙醇中的水(CaO,蒸馏) |
12.下列化学用语正确的是( )
| A. | 聚丙烯的结构简式: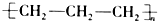 | B. | 丙烷分子的比例模型: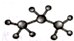 | ||
| C. | 醛基的电子式: | D. | 三硝基甲苯的结构: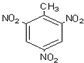 |
16.有机物X的结构简式为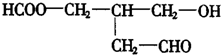 若使X通过化学变化,失去光学活性,可能发生的反应类型有( )
若使X通过化学变化,失去光学活性,可能发生的反应类型有( )
①酯化 ②水解 ③氧化 ④还原 ⑤消去.
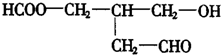 若使X通过化学变化,失去光学活性,可能发生的反应类型有( )
若使X通过化学变化,失去光学活性,可能发生的反应类型有( )①酯化 ②水解 ③氧化 ④还原 ⑤消去.
| A. | ①②③④ | B. | ①②③④⑤ | C. | ③④⑤ | D. | ②③④⑤ |
17.下列物质中,既有共价键又有离子键的是( )
| A. | MgCl2 | B. | O2 | C. | NaOH | D. | H2S |
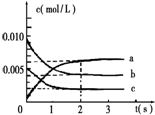 氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.
氮是大气中含量最多的气体,研究氮及其化合物对人类有重要的意义.