题目内容
15.如图为反应2H2(g)+O2(g)═2H2O(g) 的能量变化示意图.下列说法正确的是( )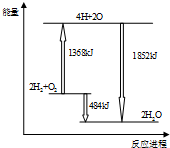
| A. | 拆开2mol H2(g)和1mol O2(g)中的化学键成为H、O原子,共放出1368kJ能量 | |
| B. | 由H、O原子形成2mol H2O(g),共吸收1852 kJ能量 | |
| C. | 2molH2(g)和1mol O2(g) 反应生成2mol H2O(l),共吸收484kJ能量 | |
| D. | 2molH2(g)和1mol O2(g)反应生成2mol H2O(g),共放出484kJ能量 |
分析 A.拆化学键吸收能量;
B.形成化学键放出能量;
C.依据反应焓变=反应物化学键键能总和-生成物化学键能总和;
D.依据反应焓变=反应物化学键键能总和-生成物化学键能总和.
解答 解:A.拆化学键吸收能量,故A错误;
B.形成化学键放出能量,故B错误;
C.依据图象数据分析计算,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量,故C错误;
D.依据图象数据分析计算,2 mol H2(g)和1 mol O2(g)反应生成2 mol H2O(g),共放出484 kJ能量,故D正确;
故选D.
点评 本题考查了反应能量变化,图象分析数据计算应用,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列离子方程式中,书写正确的是( )
| A. | 将固体CuO加入稀H2SO4中 CuO+2H+=Cu2++H2O | |
| B. | 盐酸滴加在石灰石上 CaCO3+2H+=Ca2++H2CO3 | |
| C. | Ba(OH)2溶液与稀硫酸混合 Ba2++SO42-=BaSO4↓ | |
| D. | 铜片加入稀盐酸中 Cu+2H+=Cu2++H2↑ |
6.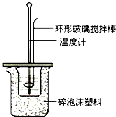 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从表中选择称量NaOH固体所需要的仪器是(填字母):a b e.
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写下表中的空白:
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-53.5kJ/mol(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.Ⅰ.配制0.50mol/L NaOH溶液
(1)若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体5.0g.
(2)从表中选择称量NaOH固体所需要的仪器是(填字母):a b e.
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
(1)写出该反应的热化学方程式(中和热为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)=$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ/mol.
(2)取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如表.
①请填写下表中的空白:
 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)acd.
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
10.下列变化的实质相似的是( )
| A. | 浓H2SO4和浓HCl在空气中敞口放置时浓度均减小 | |
| B. | SO2和Cl2均能使品红溶液褪色 | |
| C. | 浓H2SO4和稀硫酸与锌反应均生成气体 | |
| D. | 浓H2SO4、浓HNO3均可以用铁制容器贮存 |
20.将①H+、②Cl-、③NH4+、④K+、⑤S2-、⑥OH-、⑦NO3-分别加入H2O中,基本上不影响水的电离平衡的是( )
| A. | ①③⑤⑦ | B. | ②③⑦ | C. | ①⑥ | D. | ②④⑦ |
7.已知:N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.下列说法不正确的是( )
| A. | 1 mol N2(g)和3 mol H2(g)的能量之和高于2 mol NH3 (g)的能量 | |
| B. | 形成2 mol NH3(g)的化学键释放的总能量大于断裂1 mol N2 (g) 和3 mol H2 (g) 的化学键所吸收的总能量 | |
| C. | 加入催化剂是为了加大反应速率,缩短生产周期,降低生产成本 | |
| D. | 将1 mol N2(g)和3 mol H2(g)充入一密闭容器中充分反应,放出92.2 kJ 的热量 |
4.化学已渗透到人类生活的方方面面,下列说法正确的是( )
| A. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 | |
| B. | 向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 | |
| C. | “低碳生活”倡导生活中尽量减少耗能,从而减少CO2排放 | |
| D. | 铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等 |
5.要除去下列各组物质中的少量杂质,所选试剂和方法不可行的是( )
| 选项 | 物质 | 杂质 | 试剂、方法 |
| A | O2 | 水蒸气 | 通过浓H2SO4洗气 |
| B | MnO2 | 炭粉 | 在空气中灼烧 |
| C | KCl溶液 | BaCl2 | 加入适量的Na2SO4溶液,过滤 |
| D | FeSO4溶液 | CuSO4 | 加入足量铁屑,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
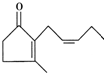 茉莉酮是一种人工合成的香料,其结构简式如图所示:
茉莉酮是一种人工合成的香料,其结构简式如图所示: