题目内容
【题目】碳的单质及其化合物是常见的物质。完成下列填空:
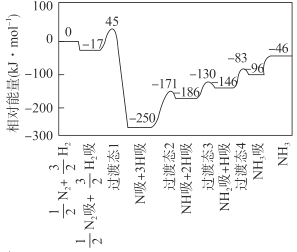
已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为:C(石墨)+O2(g)→CO2(g)+393.51kJ;C(金刚石)+O2(g)→CO2(g)+395.41kJ
(1)等质量时石墨的能量比金刚石的___(选填“高”或“低”),由石墨制备金刚石是___反应(选填“吸热”或“放热”)。
由焦炭与石英在高温的氮气流中反应,可制得一种新型陶瓷材料——氮化硅(Si3N4):C+SiO2+N2→Si3N4+CO(未配平)
(2)配平后的化学方程式各物质的化学计量数依次是___。若已知CO生成速率为v(CO)=12mol/(L·min),则N2消耗速率为v(N2)=___mol/(L·min)。
一定温度下10L密闭容器中发生某可逆反应,其平衡常数表达式为:K=![]() 。
。
(3)该反应的化学方程式为___。
(4)能判断该反应一定达到平衡状态的是___。
a.v正(H2O)=v逆(CO)
b.容器中气体的相对分子质量不随时间改变
c.消耗nmolH2同时消耗nmolCO
d.容器中物质的总物质的量不随时间改变
(5)已知常温下0.1mol/L碳酸氢钠溶液的pH=8.4,该溶液中的c(H2CO3)___c(CO32-)(选填“>”、“=”或“<”);该溶液电中性的表达式为___。
【答案】低 吸热 6、3、2、1、6 4 C(s)+H2O(g)![]() CO(g)+H2(g) ab >
CO(g)+H2(g) ab > ![]()
【解析】
(1)由石墨、金刚石燃烧生成相同产物对应热量变化可知,相同质量的石墨的能量低于金刚石,因此等质量时石墨的能量低于金刚石;由石墨制备金刚石为低能量物质转化为高能量物质,属于吸热反应;
(2)该反应中,C元素化合价从0价升高至+2价,N元素化合价从0价降低至-3价,因此C与N2的系数比为3:1,然后根据原子守恒配平方程式为:6C+3SiO2+2N2=Si3N4+6CO;根据相同方向化学反应速率之比等于其物质对应化学计量数之比可知,![]() ;
;
(3)由平衡常数可知,CO、H2作生成物,H2O(g)作生成物,根据元素守恒以及原子守恒可知该可逆反应化学方程式为:C(s)+H2O(g)![]() CO(g)+H2(g);
CO(g)+H2(g);
(4)a.v正(H2O)、v逆(CO)表示化学反应速率方向不同,当v正(H2O)=v逆(CO)时,根据化学反应速率之比等于化学计量数之比可知:v正(H2O)=v逆(CO)= v逆(H2O),可说明反应达到平衡状态,故a符合题意;
b.该反应中生成物均为气体,反应物中C为固体,反应过程中气体总质量不断变化,气体的物质的量也在不断变化,当二者比值(即气体平均相对分子质量)不变时,说明总气体的质量以及物质的量不变,可说明反应处于平衡状态,故b符合题意;
c.根据化学方程式可知,消耗n molH2时,一定会消耗n molCO,因此不能据此判断反应是否处于平衡状态,故c不符合题意;
d.该反应为等物质的量反应,反应过程中所有物质的总物质的量不变,因此不能据此判断反应是否处于平衡状态,故d不符合题意;
故答案为:ab;
(5)NaHCO3溶液中![]() 存在电离平衡和水解平衡,常温下NaHCO3溶液pH=8.4>7,说明
存在电离平衡和水解平衡,常温下NaHCO3溶液pH=8.4>7,说明![]() 的水解程度大于其电离程度,因此
的水解程度大于其电离程度,因此![]() 水解生成的H2CO3浓度大于
水解生成的H2CO3浓度大于![]() 电离生成的
电离生成的![]() 浓度;溶液呈电中性的原因是溶液中微粒存在电荷守恒,其表达式为:
浓度;溶液呈电中性的原因是溶液中微粒存在电荷守恒,其表达式为:![]() 。
。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案