题目内容
13.制取水煤气的反应为C(s)+H2O(g)═CO(g)+H2(g)△H>0,欲提高反应的速率和C(s)的转化率,可采用的措施为( )| A. | 降温 | B. | 增大水蒸气的浓度 | ||
| C. | 增大C(s)的量 | D. | 增大压强 |
分析 提高反应的速率即可以升温、升压、增加浓度等;提高C的转化率,可以使平衡正向进行,根据化学平衡移动原理来回答判断.
解答 解:A.降温,反应速率减慢,故A错误;
B.增大水蒸气的浓度,反应速率增大,平衡正向移动,C的转化率也增大,故B正确;
C.增大C(s)的量,平衡不移动,故C错误;
D.增大压强,反应速率增大,但平衡逆向移动,C的转化率减小,故D错误.
故选B.
点评 本题考查化学反应速率、平衡移动原理的应用,属于基本知识的考查,注意知识的积累是解题的关键,难度不大

练习册系列答案
相关题目
3.牙齿洁白,人人喜欢.将漂白剂沾在牙套上,牙齿咬住牙套可使牙齿变得洁白.下列物质溶于水后所得溶液可作为牙齿漂白剂的是( )
| A. | Cl2 | B. | HNO3 | C. | Na2O2 | D. | H2O2 |
1.下列各组物质,其分子数相同的是( )
| A. | 1gH2和8g O2 | |
| B. | 1molCO和22.4L水蒸气(一个标准大气压、100℃) | |
| C. | 18g水和标况时22.4L CO2 | |
| D. | 3molSO2和2mol SO3 |
5.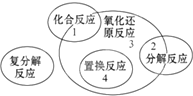 四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )
四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )
 四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )
四种基本反应类型与氧化还原反应的关系如图所示,则下列化学反应中属于区域3的反应是( )| A. | Zn+H2SO4=ZnSO4+H2↑ | B. | H2+Cl2 $\frac{\underline{\;点燃\;}}{\;}$ 2HCl | ||
| C. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | D. | 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O |
2.一定温度下,在恒容密闭容器中发生如下反应:2A(g)+B(g)?3C(g),若反应开始时充入2mol A和2mol B,达平衡后A的体积分数为a%.其他条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数大于a%的是( )
| A. | 1 mol B和3 mol C | |
| B. | 2 mol A、1mol B和1 mol He(不参加反应) | |
| C. | 1 mol B和1 mol C | |
| D. | 2 mol A、3mol B和3 mol C |
14.由铜制备硝酸铜,考虑到生产成本和减少污染,下列最合理的方法是( )
| A. | Cu$\stackrel{浓硝酸}{→}$ Cu(NO3)2 | B. | Cu$\stackrel{稀硝酸}{→}$Cu(NO3)2 | ||
| C. | Cu$\stackrel{硝酸银溶液}{→}$Cu(NO3)2 | D. | Cu $\stackrel{氧气}{→}$CuO$\stackrel{稀硝酸}{→}$Cu(NO3)2 |
 如图,甲、乙为相互串联的两个电解池,请回答下列问题:
如图,甲、乙为相互串联的两个电解池,请回答下列问题: 利用化学反应原理解决下列问题.
利用化学反应原理解决下列问题. △H=+124kJ•mol-1
△H=+124kJ•mol-1