题目内容
【题目】双级膜电渗析解离NaCl溶液制备酸碱的原理如图所示,为提高海水淡化的附加值提供了新的技术途径。已知BP为双级膜,A、C阴阳膜界面可以解离H+和OH-,下列说法正确的是( )。
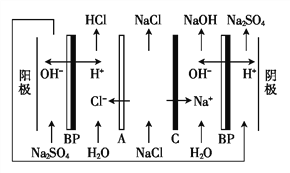
A. 根据Na+的移动方向可知,C为阴离子交换膜
B. 当电路中通过1 mol电子的电量时,会有1 mol H2生成
C. 阳极发生的电极反应为4OH-+4e-![]() O2↑+2H2O
O2↑+2H2O
D. 该方法在淡化海水时可以得到H2、O2、NaOH、HCl等物质
【答案】D
【解析】A. 根据Na+的移动方向可知,C为阳离子交换膜,A不正确;B. 当电路中通过1 mol电子的电量时,会有0.5 mol H2生成,B不正确;C. 阳极发生的电极反应为4OH-- 4e-![]() O2↑+2H2O,C不正确;D. 由题意及图示可知,该方法在淡化海水时,阳极上氢氧根离子放电生成氧气,阴极上是氢离子放电生成氢气,在BP膜和A膜之间可以得到盐酸,在BP和C之间可以得到氢氧化钠溶液, D正确。本题选D。
O2↑+2H2O,C不正确;D. 由题意及图示可知,该方法在淡化海水时,阳极上氢氧根离子放电生成氧气,阴极上是氢离子放电生成氢气,在BP膜和A膜之间可以得到盐酸,在BP和C之间可以得到氢氧化钠溶液, D正确。本题选D。

【题目】20世纪末,科学家发现海底存在大量天然气水合物晶体。在天然气水合物晶体中,有甲烷、氧气、二氧化碳、硫化氢、稀有气体等,它们在水合物晶体里是装在几个水分子构成的笼内,因而又称为笼状化合物。
(1)区分晶体和非晶体最可靠的科学方法是___________。
(2)基态C原子中,核外电子占据的最高能层的符号是______,该能层最高能级电子的电子云轮廓形状为________。
(3)H2S分子中中心原子的杂化方式为_______。H2S中H-S-H的键角比CH4中H-C-H的键角_______(填“大”“小”或“相等”)。
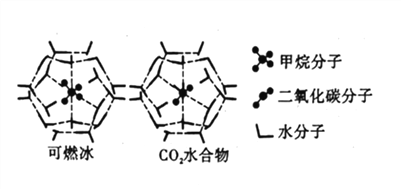
(4)CH4、CO2与H2O形成的笼状结构如图所示,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
物质 | 分子直径(nm) | 分子与H2O的结合能(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中存在的作用力有_____________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表分析,该设想的依据是_____________。
(5)已知稀有气体化合物XeF2的空间构型如图所示,据此判断中心原子Xe的杂化方式为_______(填序号)。
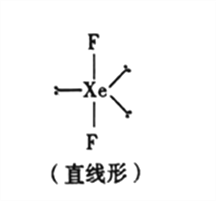
A.sp杂化 B.sp2杂化 C.sp3杂化 D.sp3d杂化
(6)氧气的晶体结构与CO2相似,晶体中若以一个分子为中心,其周围有_____个紧邻的分子,若紧邻的两个分子之间距离为anm,列式表示氧气晶体的密度为______g/cm3。