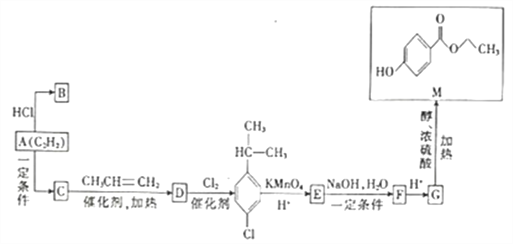
题目内容
【题目】20世纪末,科学家发现海底存在大量天然气水合物晶体。在天然气水合物晶体中,有甲烷、氧气、二氧化碳、硫化氢、稀有气体等,它们在水合物晶体里是装在几个水分子构成的笼内,因而又称为笼状化合物。
(1)区分晶体和非晶体最可靠的科学方法是___________。
(2)基态C原子中,核外电子占据的最高能层的符号是______,该能层最高能级电子的电子云轮廓形状为________。
(3)H2S分子中中心原子的杂化方式为_______。H2S中H-S-H的键角比CH4中H-C-H的键角_______(填“大”“小”或“相等”)。
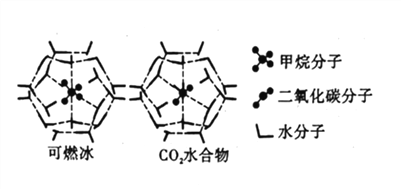
(4)CH4、CO2与H2O形成的笼状结构如图所示,其相关参数见下表。CH4与H2O形成的水合物晶体俗称“可燃冰”。
物质 | 分子直径(nm) | 分子与H2O的结合能(kJ/mol) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | 29.91 |
①“可燃冰”中存在的作用力有_____________。
②为开采深海海底的“可燃冰”,有科学家提出用CO2置换CH4的设想。已知上图中笼状结构的空腔直径为0.586nm,根据上述图表分析,该设想的依据是_____________。
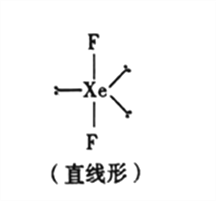
(5)已知稀有气体化合物XeF2的空间构型如图所示,据此判断中心原子Xe的杂化方式为_______(填序号)。
A.sp杂化 B.sp2杂化 C.sp3杂化 D.sp3d杂化
(6)氧气的晶体结构与CO2相似,晶体中若以一个分子为中心,其周围有_____个紧邻的分子,若紧邻的两个分子之间距离为anm,列式表示氧气晶体的密度为______g/cm3。
【答案】 对固体进行X-射线衍射实验 L 球形和哑铃形 sp3杂化 小 氢键、范德华力 ![]() 的分子直径小于笼状结构空腔直径,且
的分子直径小于笼状结构空腔直径,且![]() 与
与![]() 的结合能大于
的结合能大于![]() 与水的结合能力 D 12 128/ NA×(a×10-7)3
与水的结合能力 D 12 128/ NA×(a×10-7)3
【解析】(1)构成晶体的粒子在微观空间里呈现周期性的有序排列,晶体的这一结构特征可以通过X-射线衍射图谱反映出来;因此,区分晶体和非晶体的最可靠的科学方法是对固体进行X-射线衍射实验;正确答案:对固体进行X-射线衍射实验。
(2)基态C原子的电子排布式为![]() ,核外电子数为6,电子运动状态有6种,电子占据的最高能层符号为L,L层中s能级电子云轮廓形状为球形,p能级电子云轮廓形状为哑铃形;正确答案:L;球形和哑铃形。
,核外电子数为6,电子运动状态有6种,电子占据的最高能层符号为L,L层中s能级电子云轮廓形状为球形,p能级电子云轮廓形状为哑铃形;正确答案:L;球形和哑铃形。
(3)![]() 价层电子对个数
价层电子对个数![]() ,采取
,采取![]() 杂化;H2S分子中共价键键角接近90°,即H-S-H的键角接近90°,空间构型为V形,CH4的结构为正四面体结构, H-C-H的键角为109°28′,所以H2S中H-S-H的键角比CH4中H-C-H的键角小;正确答案: sp3杂化,小。
杂化;H2S分子中共价键键角接近90°,即H-S-H的键角接近90°,空间构型为V形,CH4的结构为正四面体结构, H-C-H的键角为109°28′,所以H2S中H-S-H的键角比CH4中H-C-H的键角小;正确答案: sp3杂化,小。
(4)①可燃冰中存在水分子,分子晶体中作用力是范德华力,水分子中存在氢键;正确答案是:氢键、范德华力。
②设想用![]() 置换
置换![]() ,根据表中数据可知
,根据表中数据可知![]() 的分子直径小于笼状结构空腔直径,且
的分子直径小于笼状结构空腔直径,且![]() 与
与![]() 的结合能大于
的结合能大于![]() 与水的结合能力,因此可能可以实现用
与水的结合能力,因此可能可以实现用![]() 置换
置换![]() ;正确答案:
;正确答案:![]() 的分子直径小于笼状结构空腔直径,且
的分子直径小于笼状结构空腔直径,且![]() 与
与![]() 的结合能大于
的结合能大于![]() 与水的结合能力。
与水的结合能力。
(5)Xe已经是8电子稳定结构,其中有一个成对电子拆开为两个单电子,与氟原子形成两个共价键,氙原子核外有10电子,氟原子核外有8个电子,二氟化氙中,氙采用sp3d杂化,正确选项D。
(6)如果分子间作用力只是范德华力,则以一个分子为中心,其周围通常有12个紧邻的分子,氧气的晶体结构与CO2相似,晶体中若以一个分子为中心,其周围有12个紧邻的分子; 从CO2晶胞结构可推氧气的晶体结构,1个晶胞中含有的氧气分子数为8×1/8+6×1/2=4,1个晶胞的体积为(a×10-7)3cm3,根据1mol 氧气含有NA个氧气分子,其质量为32g,所以氧气晶体的密度为(4×32/NA)/ (a×10-7)3=128/ NA×(a×10-7)3g/cm3正确答案:128/ NA×(a×10-7)3。

【题目】实验室中有一未知浓度的稀盐酸,某同学在实验室中进行实验测定盐酸的浓度。请完成下列填空:
(1)配制100mL0.100molL-1 NaOH标准溶液。
① 主要操作步骤:计算→称量→溶解→_______(冷却后)→洗涤(并将洗涤液移入容量瓶)→定容→摇匀→将配制好的溶液倒入试剂瓶中,贴上标签。
② 称量_____g氢氧化钠固体所需仪器有:天平(带砝码、镊子)、________、烧杯(或表面皿)。
(2)取20.00 mL待测盐酸放入锥形瓶中,并滴加23滴酚酞作指示剂,用配制的标准NaOH溶液进行滴定。重复上述滴定操作23次,记录数据如下:
实验编号 | NaOH溶液的浓度(molL-1) | 滴入NaOH溶液的体积(mL) | 待测盐酸的体积(mL) |
1 | 0.100 | 22.18 | 20.00 |
2 | 0.100 | 22.22 | 20.00 |
3 | 0.100 | 22.20 | 20.00 |
①该实验滴定达到终点的标志是_____________________________。
②根据上述数据,可计算出该盐酸的浓度约为_________________(保留三位有效数字)。
③在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有_______________。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸润洗
C.锥形瓶水洗后未干燥
D.碱式滴定管尖嘴部分有气泡,滴定后消失
E.称量NaOH固体时,混入少量KOH杂质
④现用以上实验配制的0.10 molL-1NaOH溶液测定食醋中乙酸的浓度,应该选用的指示剂为_______。