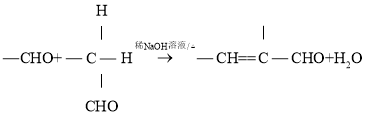
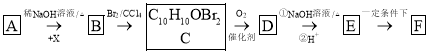题目内容
【题目】NA代表阿伏加德罗常数,下列说法正确的是
A. 9gD2O中含有的电子数为5NA
B. 氢氧化铁胶体带正电荷。用含0.1mol的FeCl3溶液制成的氢氧化铁胶体中,胶粒数小于0.1NA
C. 常温下,7.8gNa2O2与100mL0.05mol/L的HCl溶液反应,产生的气体体积大于1120mL
D. 0.1mol/LNa2CO3溶液中:H2CO3、CO32-、HCO3-物质的量之和为0.1NA
【答案】C
【解析】A.9g重水的物质的量为:![]() =0.45mol,0.45mol重水中含有4.5mol电子,含有的电子数为4.5NA,选项A错误;B、FeCl3水解生成氢氧化铁胶体,FeCl3不能完全水解,且每个胶粒由多个氢氧化铁聚集而成,故氢氧化铁胶体中胶粒数小于0.1NA,选项B错误;C、根据反应2Na2O2+4HCl=4NaCl+O2↑+2H2O可知,反应产生的气体标准状况下体积为
=0.45mol,0.45mol重水中含有4.5mol电子,含有的电子数为4.5NA,选项A错误;B、FeCl3水解生成氢氧化铁胶体,FeCl3不能完全水解,且每个胶粒由多个氢氧化铁聚集而成,故氢氧化铁胶体中胶粒数小于0.1NA,选项B错误;C、根据反应2Na2O2+4HCl=4NaCl+O2↑+2H2O可知,反应产生的气体标准状况下体积为![]() =1.12L=1120mL,常温下,产生的气体体积大于1120mL,选项C正确;D、没有给定体积,无法计算离子物质的量总和,选项D错误。答案选C。
=1.12L=1120mL,常温下,产生的气体体积大于1120mL,选项C正确;D、没有给定体积,无法计算离子物质的量总和,选项D错误。答案选C。

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目