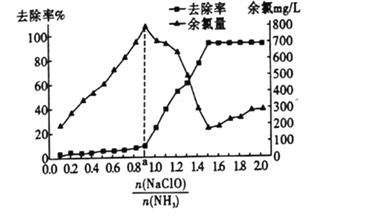
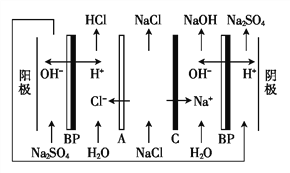
题目内容
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 使甲基橙呈红色的溶液中:Na+、Ba2+、Cl-、NO3-
B. c( OH-) <![]() 的溶液中:Na+、Ca2+、ClO-、NO3-
的溶液中:Na+、Ca2+、ClO-、NO3-
C. 含有大量Fe( NO3)2 的溶液中:H+、NH4+、Cl-、SO42-
D. 水电离的c( H+)= 1× 10 -13mol/L的溶液中:K+、Mg2+、Br-、CH3COO-
【答案】A
【解析】A项,使甲基橙呈红色的溶液呈酸性,酸性条件下离子间不反应,能大量共存;B项,c(OH-)<![]() 即c(OH-)
即c(OH-)![]() c(H+),溶液呈酸性,酸性条件下H+与ClO-结合成弱酸HClO,ClO-不能大量存在;C项,酸性条件下NO3-表现强氧化性,发生离子反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,含大量Fe(NO3)2的溶液中H+不能大量存在;D项,水电离的c(H+)=1×10-13mol/L,常温下溶液的pH可能为1或13,若溶液呈酸性CH3COO-不能大量存在,若溶液呈碱性Mg2+不能大量存在;答案选A。
c(H+),溶液呈酸性,酸性条件下H+与ClO-结合成弱酸HClO,ClO-不能大量存在;C项,酸性条件下NO3-表现强氧化性,发生离子反应:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O,含大量Fe(NO3)2的溶液中H+不能大量存在;D项,水电离的c(H+)=1×10-13mol/L,常温下溶液的pH可能为1或13,若溶液呈酸性CH3COO-不能大量存在,若溶液呈碱性Mg2+不能大量存在;答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO和Cl2反应得到,化学方程式为2NO(g)+Cl2(g) ![]() 2NOCl(g)。
2NOCl(g)。
(1)氮氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+NOCl(g)
NaNO3(s)+NOCl(g)
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g)
2NaNO3(s)+2NO(g)+Cl2(g)
③2NO(g)+Cl2(g) ![]() 2NOCl(g)
2NOCl(g)
设反应①②③对应的平衡常数依次为K1、K2、K3,则K1、K2、K3之间的关系为____________。
(2)300 ℃时,2NOCl(g) ![]() 2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
2NO(g)+Cl2(g)。正反应速率的表达式为v正=k·cn(NOCl)(k为速率常数,只与温度有关),测得速率与浓度的关系如表所示:
序号 | c(NOCl)/mol·L-1 | v/mol·L-1·s-1 |
① | 0.30 | 3.60×10-9 |
② | 0.60 | 1.44×10-8 |
③ | 0.90 | 3.24×10-8 |
n=________,k=________。
(3)在1 L恒容密闭容器中充入2 mol NO(g)和1 mol Cl2(g),在不同温度下测得c(NOCl)与时间t的关系如图A所示:反应开始到10 min时Cl2的平均反应速率v(Cl2)=________ mol·L-1·min-1。
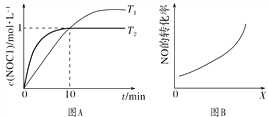
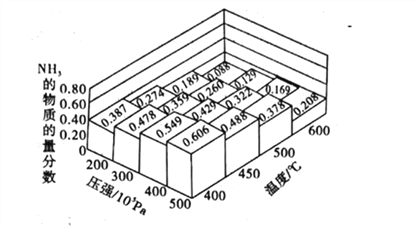
(4)在密闭容器中充入NO(g)和Cl2(g),改变外界条件[温度、压强、![]() 、与催化剂的接触面积],NO的转化率变化关系如图B所示。X代表________。
、与催化剂的接触面积],NO的转化率变化关系如图B所示。X代表________。