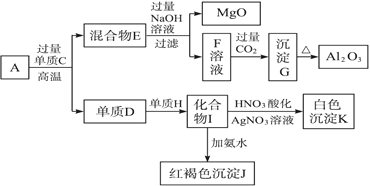
题目内容
【题目】常温下,在10mL0.1mol/LNa2CO3溶液中逐滴加入0..1mol/LHCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法不正确的是
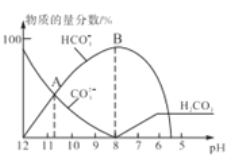
A. 常温下,水解常数Kh(CO32-)的数量级为10-4
B. 当溶液是中性时,溶液的总体积大于20mL
C. 在0.1mol/LNa2CO3溶液中:c(OH-)>c(H2CO3)+c(HCO3-)+c(H+)
D. 在B点所示的溶液中,离子浓度最大的是HCO3-
【答案】D
【解析】分析:由A点可以确定碳酸的二级电离常数和碳酸根的水解常数。碳酸钠溶液和碳酸氢钠溶液都呈碱性。根据质子守恒可以判断相关离子浓度的大小关系。
详解:A. 由图中信息可知,A点c(HCO3-)=c(CO32-),则水解常数Kh(CO32-)![]() ,A点对应的11>pH>10,则
,A点对应的11>pH>10,则![]() ,所以,水解常数Kh(CO32-)的数量级为10-4,A正确;
,所以,水解常数Kh(CO32-)的数量级为10-4,A正确;
B. 0.1mol/LNa2CO3溶液呈碱性,当加入10mL 0..1mol/LHCl溶液时碳酸根全部转化为碳酸氢根,此时溶液仍呈碱性,所以,当溶液是中性时,溶液的总体积大于20mL,B正确;
C. 在0.1mol/LNa2CO3溶液中,由质子守恒可知,c(OH-)=2c(H2CO3)+c(HCO3-)+c(H+),所以,c(OH-)>c(H2CO3)+c(HCO3-)+c(H+),C正确;
D. 由物料守恒可知,在B点所示的溶液中,离子浓度最大的是Na+,D不正确。
本题选D。

 备战中考寒假系列答案
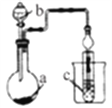
备战中考寒假系列答案【题目】如图装置,其中试剂b为浓硫酸,则下列实验设计能达到实验目的的是
选项 | 试剂a | 试剂c | 实验目的 |
|
A | MnO2和NaCl | 紫色石蕊溶液 | 验证Cl2的漂白性 | |
B | 蔗糖 | 澄清石灰水 | 验证CO2的生成 | |
C | FeS | 溴水 | 验证非金属性:Br>S | |
D | Na2SO3 | 品红溶液 | 验证SO2的漂白性 |
A. A B. B C. C D. D
【题目】碳的氧化物和氮的氧化物与人类生活息息相关,它们之间有多种相互转化关系,可以变废为宝。
(1)为了模拟汽车尾气在催化转化器内的工作反应情况,控制定条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(NO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=________,此温度下,该反应的平衡常数K=_______
②能说明上述反应达到平衡状态的是____________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
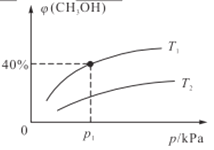
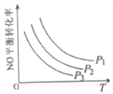
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。则NO的平衡转化率随温度升高而减小的原因是___,压强P1、P2、P3的大小关系是____________,理由是_______________________。
(2)用氨气催化氧化还原法脱硝(NOx)
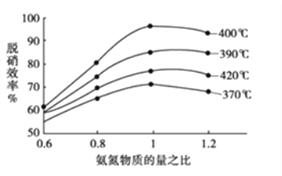
①根据下图判断提高脱硝效率(单位时间内NOx浓度变化占烟气初始浓度的百分比)的最佳条件是:______________________。
②已知:N2(g)+O2(g)=2NO(g) △H=+akJ/mol
N2(g)+3H2(g)![]() 2NH3(g) △H=-bk/mol
2NH3(g) △H=-bk/mol
2H2(g)+O2(g)=2H2O(g) △H=-ckJ/mol 其中a、b、C均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=____________。
4N2(g)+6H2O(g) △H=____________。