题目内容
【题目】粉末状样品A是由等物质的量的MgO和Al2O3与常见金属氧化物B组成的混合物。A有如图所示的转化关系。
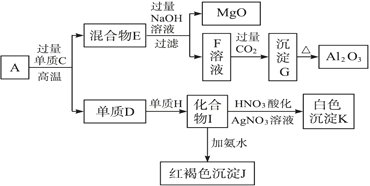
请完成下列问题:
(1) 金属单质C和非金属单质H的化学式分别是__________、_______________
(2) 写出由I生成J的离子方程式:___________________
(3) 写出由F生成G的离子方程式:____________________________
(4) 若10.7 g样品A中MgO、Al2O3和B的物质的量均为0.05 mol,则B的化学式为___________。
(5) 若B中金属原子与氧原子的粒子数之比为2∶3,取7.10 g样品A恰好与含x mol HCl的盐酸完全反应,则x的取值范围是___________(保留小数点后两位)。
【答案】Al Cl2 Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- FeO 0.26<x<0.40
【解析】
从“红褐色沉淀”可知J是Fe(OH)3,则D是Fe,B应是Fe的氧化物,通过铝热反应生成铁单质,所以C是Al。E是MgO、Al2O3和过量的Al组成的混合物;MgO与氢氧化钠溶液不反应,所以F是偏铝酸钠和氢氧化钠的混合溶液;偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀,G是Al(OH)3;从“白色沉淀”可知K是AgCl,则H是Cl2,I是氯化铁。
(1)根据以上分析,C是Al ,H是Cl2;(2) 氯化铁与氨水反应生成氢氧化铁沉淀和氯化铵,反应离子方程式是Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+; (3) 偏铝酸钠和过量二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式是AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;(4) 0.05mol MgO和Al2O3的质量分别是2g、5.1g,所以0.05molB的质量是10.7g-2g-5.1g=3.6g,B的摩尔质量是![]() 72g/mol,故B是FeO;(5) B中金属原子与氧原子的粒子数之比为2∶3,则B是Fe2O3。若7.10 g样品全是MgO和Al2O3,设MgO和Al2O3的物质的量是amol,
72g/mol,故B是FeO;(5) B中金属原子与氧原子的粒子数之比为2∶3,则B是Fe2O3。若7.10 g样品全是MgO和Al2O3,设MgO和Al2O3的物质的量是amol,![]() ,a=0.05mol,消耗HCl 的物质的量是2a+6a=0.4mol;若7.10 g样品全是Fe2O3,Fe2O3的物质的量是
,a=0.05mol,消耗HCl 的物质的量是2a+6a=0.4mol;若7.10 g样品全是Fe2O3,Fe2O3的物质的量是![]() ,消耗HCl 的物质的量是0.0443
,消耗HCl 的物质的量是0.0443![]() =0.26mol;根据极值法,x的取值范围是0.26<x<0.40。
=0.26mol;根据极值法,x的取值范围是0.26<x<0.40。