题目内容
【题目】碳的氧化物和氮的氧化物与人类生活息息相关,它们之间有多种相互转化关系,可以变废为宝。
(1)为了模拟汽车尾气在催化转化器内的工作反应情况,控制定条件,让反应在恒容密闭容器中进行如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
N2(g)+2CO2(g),用传感器测得不同时间NO和CO的依度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)(10-4mol/L) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(NO)(10-3mol/L) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前2s内的平均反应速率v(N2)=________,此温度下,该反应的平衡常数K=_______
②能说明上述反应达到平衡状态的是____________。
A.2n(CO2)=n(N2) B.混合气体的平均相对分子质量不变
C.气体密度不变 D.容器内气体压强不变
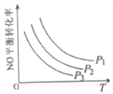
③当NO与CO浓度相等时,体系中NO的平衡转化率与温度、压强的关系如图所示。则NO的平衡转化率随温度升高而减小的原因是___,压强P1、P2、P3的大小关系是____________,理由是_______________________。
(2)用氨气催化氧化还原法脱硝(NOx)
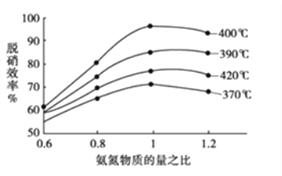
①根据下图判断提高脱硝效率(单位时间内NOx浓度变化占烟气初始浓度的百分比)的最佳条件是:______________________。
②已知:N2(g)+O2(g)=2NO(g) △H=+akJ/mol
N2(g)+3H2(g)![]() 2NH3(g) △H=-bk/mol
2NH3(g) △H=-bk/mol
2H2(g)+O2(g)=2H2O(g) △H=-ckJ/mol 其中a、b、C均为大于0。
则放热反应:4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=____________。
4N2(g)+6H2O(g) △H=____________。
【答案】 1.875×10-4mol·L-1·s-1 5000L/mol BD 该反应正反应放热,升高温度,平衡逆向移动,NO的平衡转化率减小 P1>P2>P3 正反应为体积减小的反应,增压平衡正向移动,NO的衡转化率增大 400℃、氨氮物质的量之比为1 -(2a-2b+3c)或2b-2a-3c kJ/mol
【解析】试题分析:(1)①前2s内NO的浓度变化是7.5×10-4mol·L-1,则N2的浓度变化是3.75×10-4mol·L-1,根据![]() 计算速率;根据表格数据,反应在4s时达到平衡状态,根据K=
计算速率;根据表格数据,反应在4s时达到平衡状态,根据K=![]() 计算 。②根据平衡标志分析;③NO的平衡转化率随温度升高而减小,说明升高温度平衡逆向移动,正反应放热;正反应为体积减小的反应,增压平衡正向移动;(2) ①根据图像,400℃、氨氮物质的量之比为1时,脱硝效率最高;②根据盖斯定律计算4NO(g)+4NH3(g)+O2(g)
计算 。②根据平衡标志分析;③NO的平衡转化率随温度升高而减小,说明升高温度平衡逆向移动,正反应放热;正反应为体积减小的反应,增压平衡正向移动;(2) ①根据图像,400℃、氨氮物质的量之比为1时,脱硝效率最高;②根据盖斯定律计算4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g)的△H;
4N2(g)+6H2O(g)的△H;
解析:(1) ①前2s内NO的浓度变化是7.5×10-4mol·L-1,则N2的浓度变化是3.75×10-4mol·L-1, ![]() 1.875×10-4mol·L-1·s-1;
1.875×10-4mol·L-1·s-1;
根据表格数据,反应在4s时达到平衡状态

K=![]() 5000L/mol;
5000L/mol;
② 2n(CO2)=n(N2),都是指正反应方向,所以不一定平衡,故A错误;根据![]() ,混合气体的平均相对分子质量是变量,所以混合气体的平均相对分子质量不变,一定达到平衡状态,故B正确;根据
,混合气体的平均相对分子质量是变量,所以混合气体的平均相对分子质量不变,一定达到平衡状态,故B正确;根据![]() ,气体密度是恒量,气体密度不变,不一定达到平衡状态,故C错误;反应前后气体物质的量是变量,压强是变量,所以容器内气体压强不变,一定达到平衡状态,故D正确。③正反应放热,升高温度平衡逆向移动,所以NO的平衡转化率随温度升高而减小;正反应为体积减小的反应,增压平衡正向移动,NO转化率越大,说明压强越大,所以压强P1>P2>P3;(2) ①根据图像,400℃、氨氮物质的量之比为1时,脱硝效率最高,所以脱硝的最佳条件是400℃、氨氮物质的量之比为1;② Ⅰ、N2(g)+O2(g)=2NO(g) △H=+akJ/mol
,气体密度是恒量,气体密度不变,不一定达到平衡状态,故C错误;反应前后气体物质的量是变量,压强是变量,所以容器内气体压强不变,一定达到平衡状态,故D正确。③正反应放热,升高温度平衡逆向移动,所以NO的平衡转化率随温度升高而减小;正反应为体积减小的反应,增压平衡正向移动,NO转化率越大,说明压强越大,所以压强P1>P2>P3;(2) ①根据图像,400℃、氨氮物质的量之比为1时,脱硝效率最高,所以脱硝的最佳条件是400℃、氨氮物质的量之比为1;② Ⅰ、N2(g)+O2(g)=2NO(g) △H=+akJ/mol
Ⅱ、N2(g)+3H2(g)![]() 2NH3(g) △H=-bk/mol
2NH3(g) △H=-bk/mol
Ⅲ、2H2(g)+O2(g)=2H2O(g) △H=-ckJ/mol
根据盖斯定律Ⅲ![]() Ⅰ
Ⅰ![]() Ⅱ
Ⅱ![]() 得4NO(g)+4NH3(g)+O2(g)
得4NO(g)+4NH3(g)+O2(g)![]() 4N2(g)+6H2O(g) △H=2b-2a-3c kJ/mol;
4N2(g)+6H2O(g) △H=2b-2a-3c kJ/mol;

【题目】某研究小组为了探究NaClO溶液的性质,设计了下列实验,并记录实验现象。
实验装置 | 实验序号 | 滴管试剂 | 试管试剂 | 实验现象 |
| ① | 0.2 mol/L NaClO溶液 | 饱和Ag2SO4溶液 | 产生白色沉淀 |
② | CH3COOH溶液 | 光照管壁有无色气泡 | ||
③ | 0.2mol/LFeSO4酸性溶液和KSCN溶液 | 溶液变红 | ||
④ | 0.2mol/L的AlCl3溶液 | 产生白色沉淀 |
则以下判断不正确的是
A. 实验①:发生的反应为Ag++ClO-+H2O=AgCl↓+2OH- B. 实验②:无色气体为O2
C. 实验③:还原性强弱顺序Fe2+>Cl- D. 实验④:ClO-与Al3+的水解相互促进