题目内容
【题目】能源是人类生存、社会发展不可或缺的物质,CO、H2、CH3OH均是重要的能源物质。
(1)已知:氧气中化学键的键能为497kJ/mol,二氧化碳中C=O键的键能为745kJ/mol。
2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol
H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ/mol
CH3OH(g)+![]() O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol
CO(g)+2H2(g)![]() CH3OH(g) △H4
CH3OH(g) △H4
则使1molCO(g)完全分解成原子所需要的能量至少为___,△H4=___。
(2)某密闭容器中存在反应:CO(g)+2H2(g)![]() CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
CH3OH(g),起始时容器中只有amol/LCO和bmol/LH2,平衡时测得混合气体中CH3OH的物质的量分数[φ(CH3OH)]与温度(T)、压强(p)之间的关系如图所示。
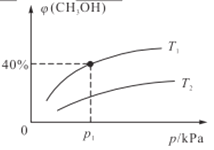
①温度T1和T2时对应的平衡常数分别为K1、K2,则K1____K2(填“>”“<”“=”);若恒温(T1)恒容条件下,起始时a=1、b=2,测得平衡时混合气体的压强为p1kPa,则T1时该反应的压强平衡常数Kp=___。(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,用含p1的代数式表示)
②若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,再次达平衡后,CO的转化率为α2,则α1_____α2 (填“>”“<”“=”“无法确定”)
③若恒温恒容条件下,起始时a=1、b=2,则下列叙述能说明反应达到化学平衡状态的是____。
A.CO、H2的物质的量浓度之比为1:2,且不再随时间的变化而变化
B.混合气体的密度不再随时间的变化而变化
C.混合气体的平均摩尔质量不再随时间的变化而变化
D.若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化
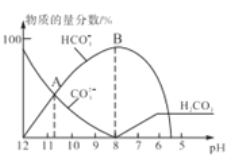
(3)工业上常用氨水吸收含碳燃料燃烧中产生的温室气体CO2,其产物之一是NH4HCO3。已知常温下碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,NH3·H2O的电离常数K=1.8×10-5,则所得到的NH4HCO3溶液中c(NH4+)_____c(HCO3-)(填“>”“<”“=”)。
【答案】 958.5kJ -107kJ/mol > 25/(2p12)(kPa)-2 < CD >
【解析】分析:反应等于反应物的键能总和与生成物键能总和的差。根据盖斯定律可以由已知反应的反应热求出与之相关的未知反应的反应热。放热反应的平衡常数随温度升高而减小。在恒温恒容的平衡体系中再充入与原投料相同的反应物,则平衡向气体分子数减少的方向移动,反应物转化率增大。由水解程度可以比较离子浓度的大小关系。
详解:(1)由题中信息可知,2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol,氧气中化学键的键能为497kJ/mol,二氧化碳中C=O键的键能为745kJ/mol,设一氧化碳的键能为x,则△H1=2x+497kJ/mol –(745 kJ/mol)![]() -566kJ/mol,所以,x=958.5kJ/mol,则使1molCO(g)完全分解成原子所需要的能量至少为958.5kJ。已知:①2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol;②H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ/mol;③CH3OH(g)+
-566kJ/mol,所以,x=958.5kJ/mol,则使1molCO(g)完全分解成原子所需要的能量至少为958.5kJ。已知:①2CO(g)+O2(g)=2CO2(g) △H1=-566kJ/mol;②H2O(g)+CO(g)=H2(g)+CO2(g) △H2=-41kJ/mol;③CH3OH(g)+![]() O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol。根据盖斯定律,由①
O2(g)==CO2(g)+2H2O(g) △H3=-660kJ/mol。根据盖斯定律,由①![]() -②
-②![]() -③可得CO(g)+2H2(g)
-③可得CO(g)+2H2(g)![]() CH3OH(g),则△H4=(-566kJ/mol)
CH3OH(g),则△H4=(-566kJ/mol)![]() -(-41kJ/mol)
-(-41kJ/mol)![]() = -107kJ/mol。
= -107kJ/mol。
(2)①该反应为放热反应,故φ(CH3OH)随温度升高而减小,该反应的平衡常数也随温度的升高而减小,所以,温度T1<T2,K1>K2;若恒温(T1)恒容条件下,起始时a=1、b=2,起始量之比等于化学计量数之比,变化量之比也等于化学计量数之比,则CO和H2的物质的量分数之比也等于化学计量数之比。由图中信息可知,到达平衡状态时,φ(CH3OH)=40%,则φ(CO)=(1-40%)![]() ,φ(H2)= (1-40%)
,φ(H2)= (1-40%)![]() 40%,测得平衡时混合气体的压强为p1kPa,则T1时该反应的压强平衡常数Kp=
40%,测得平衡时混合气体的压强为p1kPa,则T1时该反应的压强平衡常数Kp=![]() (kPa)-2。
(kPa)-2。
②在恒温恒容的平衡体系中再充入与原投料相同的反应物,则平衡向气体分子数减少的方向移动。若恒温恒容条件下,起始时充入1molCO和2molH2,达平衡后,CO的转化率为α1,此时,若再充入1molCO和2molH2,平衡向再次达平衡后,CO的转化率变大,则α1<α2.
③若恒温恒容条件下,起始时a=1、b=2,投料比与化学计量数之比相同,则下列叙述:A.由于变化量之比等于化学计量数之比,故CO、H2的物质的量浓度之比恒为1:2,,无法据此判断是否达到平衡状态,A不正确;B.由于气体的总质量和总体积均不变,故混合气体的密度不随时间的变化而变化,无法根据密度判断是否达到平衡,B不正确;C.混合气体的物质的量是变量,故混合气体的平均摩尔质量也是变量,当其不再随时间的变化而变化时,达到平衡,C正确;D.平衡常数只与温度有关,若将容器改为绝热恒容容器时,平衡常数K不随时间变化而变化时,该反应达到平衡状态,D正确。综上所述,能说明反应达到化学平衡状态的是CD。
(3)已知常温下碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,则水解常数Kh(HCO3-)=![]() 2.3×10-8>K2,所以,HCO3-的水解程度远远大于其电离程度,其电离可以忽略不计。NH3·H2O的电离常数K=1.8×10-5,则Kh(NH4+)
2.3×10-8>K2,所以,HCO3-的水解程度远远大于其电离程度,其电离可以忽略不计。NH3·H2O的电离常数K=1.8×10-5,则Kh(NH4+)![]() ,所以,NH4+的水解程度小于HCO3-的,则所得到的NH4HCO3溶液中c(NH4+)>c(HCO3-)。
,所以,NH4+的水解程度小于HCO3-的,则所得到的NH4HCO3溶液中c(NH4+)>c(HCO3-)。