题目内容
5.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1molN2和3molH2,在一定条下使该反应发生.下列有关说法正确的是( )| A. | 达到化学平衡时,N2将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,N2和H2的转化率相同且c(N2):c(H2)=1:3 |
分析 A.可逆反应中反应物不能完全转化;
B.平衡时反应物、生成物的浓度之比与起始浓度及转化率有关;
C.可逆反应是动态平衡,平衡时正逆相等但不为0;
D.氮气与氢气起始物质的量为1:3,且二者按物质的量1:3反应,故二者转化率相等,体系中氮气、氢气浓度之比始终为1:3.
解答 解:A.合成氨属于可逆反应,到达平衡时氮气不能完全转化为NH3,故A错误;
B.平衡时反应物、生成物的浓度之比与起始浓度及转化率有关,平衡时浓度不一定等于化学计量数之比,故B错误;
C.可逆反应是动态平衡,平衡时正逆相等但不为0,故C错误;
D.氮气与氢气起始物质的量为1:3,且二者按物质的量1:3反应,故二者转化率相等,体系中氮气、氢气浓度之比始终为1:3,故D正确,
故选:D
点评 本题考查可逆反应特征、平衡状态、化学平衡计算等,比较基础,注意对基础知识的理解掌握.

练习册系列答案
相关题目
19.常温下,下列有关叙述正确的是( )
| A. | 醋酸溶液加水稀释后,各离子浓度均减小 | |
| B. | 将Na2SO3溶液、FeCl3溶液蒸干均得不到原溶质 | |
| C. | 加热滴有酚酞的CH3COONa溶液,溶液颜色变浅 | |
| D. | 0.1 mol/L Na2CO3溶液中,c(HCO3-)>c(CO32-) |
20.某实验中得到异戊醇和乙酸异戊酯的液体混合物,其信息如下:
用蒸馏的方法分离二者的混合物时,若从130℃便开始收集馏分,则使乙酸异戊酯的实验产率(实验产量与理论产量之比)( )
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 水中溶解性 | |
| 异戍醇 | 88 | 0.8123 | 131 | 微溶 |
| 乙酸异戊酯 | 130 | 0.8670 | 142 | 难溶 |
| A. | 偏高 | B. | 偏低 | C. | 不变 | D. | 无法判断 |
4.下列有关指定溶液的说法正确的是( )
| A. | 将0.2mol•L-1氨水与0.2mol•L-1盐酸混合,c(NH3•H20)+c(NH4+)=c(Cl-) | |
| B. | 常温下NH4A溶液中的pH=6,则c(A-)-c(NH4+)=9.9×10-7mol•L-1 | |
| C. | c(NH4+)相等的NH4Cl,NH4HCO3溶液中,溶质初始浓度:c(NH4Cl)=c(NH4HCO3) | |
| D. | 将0.2molCO2缓慢通入含有0.3molNAOH的溶液中,c(CO32-)>c(HCO3-)>c(H2CO3) |
14.已知NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 在1L 0.1mol•L-1氟化钠溶液中含有F-和HF数目之和为0.1NA | |
| B. | 300mL 2mol/L蔗糖溶液中所含分子数为0.6NA | |
| C. | 标准状况下,1.8gD2O中含有NA个中子 | |
| D. | 标准状况下,2.24L三氯甲烷中含有氯原子数目为0.3NA |
15.下列反应的离子方程式正确的是( )
| A. | 铁屑与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 氢氧化铝溶于稀硝酸:OH-+H+=H2O | |
| D. | 硫酸铁与氢氧化钡反应:Ba2++SO42-=BaSO4↓ |
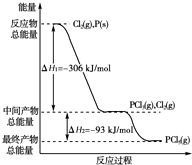 红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).
红磷P(s)和Cl2(g)发生反应生成PCl3(g),继续反应生成PCl5(g).反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据).