题目内容
10.将对H2的相对密度为4.25的N2 和H2的 混合气体通入体积固定密闭容器中,在一定条件下反 应生成NH3,达到平衡时,NH3占25%(体积分数).(1)进入容器N2和H2的 体积比1:3.
(2)N2的转化率40%.
(3)反应前后的密度比1:1.
(4)反应前后的压强比5:4.
分析 设的N2 和H2的物质的量分别为xmol、ymol,则$\frac{28x+2y}{x+y}$=4.25×2,整理可得x:y=1:3,假设N2 和H2的物质的量分别为1mol、3mol,达到平衡时,NH3占25%,则:
N2(g)+3H2(g)?2NH3(g)
起始(mol):1 3 0
转化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
所以$\frac{2x}{4-2x}$=25%,解得x=0.4
(1)相同条件下,气体体积之比等于其物质的量之比;
(2)转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
(3)混合气体总质量不变,容器容积不变,混合气体密度不变;
(4)恒温恒容下,压强之比等于气体物质的量之比.
解答 解:设的N2 和H2的物质的量分别为xmol、ymol,则$\frac{28x+2y}{x+y}$=4.25×2,整理可得x:y=1:3,假设N2 和H2的物质的量分别为1mol、3mol,达到平衡时,NH3占25%,则:
N2(g)+3H2(g)?2NH3(g)
起始(mol):1 3 0
转化(mol):x 3x 2x
平衡(mol):1-x 3-3x 2x
所以$\frac{2x}{4-2x}$=25%,解得x=0.4
(1)相同条件下,气体体积之比等于其物质的量之比,故进入容器N2和H2的 体积比为1mol:3mol=1:3,故答案为:1:3;
(2)氮气转化率=$\frac{0.4mol}{1mol}$×100%=40%,故答案为:40%;
(3)混合气体总质量不变,容器容积不变,混合气体密度不变,即反应前后的密度比为1:1,故答案为:1:1;
(4)恒温恒容下,压强之比等于气体物质的量之比,故反应前后的压强比为(1+3)mol:(4-0.8)mol=5:4,故答案为:5:4.
点评 本题考查化学平衡计算,关键是计算氮气与氢气起始物质的量之比,注意利用赋值法解答,注意三段式解题法在化学平衡计算中应用.

①盐酸;②CuSO4溶液;③氢氧化钠溶液;④AgNO3溶液.
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
| A. | 达到化学平衡时,N2将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,N2和H2的转化率相同且c(N2):c(H2)=1:3 |
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH$→_{170℃}^{H_{2}SO_{4}(浓)}$CH2=CH2,CH2=CH2+Br2→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚.用少量溴和足量的乙醇制备1,2-二溴乙烷的装置如图所示:
有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是d
a.引发反应 b.加快反应速度c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置C中应加入c,(填序号)其目的是吸收反应中可能生成的酸性气体
a.水 b.浓硫酸c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制备反应已经结束的最简单方法是溴的颜色完全褪去
(4)将1,2-二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在下层(填“上”、“下”)
(5)若产物中有少量未反应的Br2,最好用b洗涤除去(填序号)
a.水b.氢氧化钠溶液c.碘化钠溶液d.乙醇
(6)若产物中有少量副产物乙醚,可用蒸馏的方法除去
(7)反应过程中应用冷水冷却装置D,其主要目的是乙烯与溴反应时放热,冷却可避免溴的大量挥发但又不能过度冷却(如用冰水),其原因是1,2-二溴乙烷的凝固点较低(9℃),过度冷却会使其凝固而使气路堵塞.
 短周期元素X.Y.Z.W在元素周期表中的相对位置如图所示,其中w原子的最外层电子数是最内层电子数的3倍.下列判断不正确的是( )
短周期元素X.Y.Z.W在元素周期表中的相对位置如图所示,其中w原子的最外层电子数是最内层电子数的3倍.下列判断不正确的是( )| A. | x与同主族且相邻元素的气态氢化物的沸点,前者高于后者 | |
| B. | 含Y元素的盐溶液有的显酸性,有的显碱性 | |
| C. | x的气态氢化物与w的最高价氧化物的水化物反应只能生成一种盐 | |
| D. | x与H、O元素形成的化合物可以组成一种盐,其中X.H.O元素原子个数之比为2:4:3 |
| A. | 钠和钾的合金可用于快中子反应堆作热交换剂 | |
| B. | 可用超纯硅制造的单晶硅来制芯片 | |
| C. | 可利用二氧化碳制造全降解塑料 | |
| D. | 氯气有毒,不能用于药物的合成 |
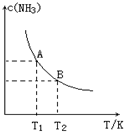 将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25%,反应中放出a kJ热量.
将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25%,反应中放出a kJ热量.