题目内容
15.下列反应的离子方程式正确的是( )| A. | 铁屑与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ | |
| B. | 稀硫酸与氢氧化钡溶液反应:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| C. | 氢氧化铝溶于稀硝酸:OH-+H+=H2O | |
| D. | 硫酸铁与氢氧化钡反应:Ba2++SO42-=BaSO4↓ |
分析 A.不符合反应客观事实;
B.二者反应生成硫酸钡和水;
C.氢氧化铝为沉淀,应保留化学式;
D.漏掉氢氧根离子与三价铁离子的反应.
解答 解:A.铁屑与稀盐酸反应,离子方程式:Fe+2H+=Fe2++H2↑,故A错误;
B.稀硫酸与氢氧化钡溶液反应,离子方程式:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故B正确;
C.氢氧化铝溶于稀硝酸,离子方程式:Al(OH)3+3H+=3H2O+Al3+,故C错误;
D.硫酸铁与氢氧化钡反应,离子方程式:2Fe3++6OH-+3Ba2++3SO42-=3BaSO4↓+2Fe(OH)3↓,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,题目难度不大.

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
5.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1molN2和3molH2,在一定条下使该反应发生.下列有关说法正确的是( )
| A. | 达到化学平衡时,N2将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,N2和H2的转化率相同且c(N2):c(H2)=1:3 |
6.如表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.试回答下列问题:
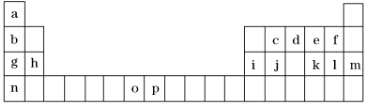
(1)元素p为26号元素,请写出其基态原子的电子排布式1s22s22p63s23p63d64s2.
(2)d与a反应的产物的分子中,中心原子的杂化形式为sp3.
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量.
(4)o、p两元素的部分电离能数据列于下表:
比较两元素的I2、I3可知,气态o2+再失去一个电子比气态p2+再失去一个电子难.对此,你的解释是Mn2+的3d轨道电子排布为半满状态,比较稳定.
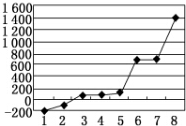
(5)第三周期8种元素按单质熔点高低的顺序如图所示,其中电负性最大的是2(填下图中的序号).
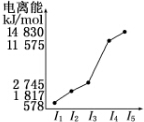
(6)表中所列的某主族元素的电离能情况如图所示,则该元素是Al(填元素符号).

(1)元素p为26号元素,请写出其基态原子的电子排布式1s22s22p63s23p63d64s2.
(2)d与a反应的产物的分子中,中心原子的杂化形式为sp3.
(3)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:电子从能量较高的轨道跃迁到能量较低的轨道时,以光(子)的形式释放能量.
(4)o、p两元素的部分电离能数据列于下表:
| 元素 | o | p | |
| 电离能kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
(5)第三周期8种元素按单质熔点高低的顺序如图所示,其中电负性最大的是2(填下图中的序号).

(6)表中所列的某主族元素的电离能情况如图所示,则该元素是Al(填元素符号).

3.下列有关高分子化合物的叙述正确的是( )
| A. | 高分子化合物极难溶解 | |
| B. | 高分子化合物依靠分子间作用力结合,材料强度较小 | |
| C. | 高分子均为长链状分子 | |
| D. | 高分子材料均为混合物 |
10.下列热化学方程式的书写,正确的是( )
| A. | 500℃、30 MPa下,将0.5mol N2和1.5mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2+3H2?2NH3△H=-38.6kJ•mol-1 | |
| B. | 已知在105Pa,298K条件下,2mol H2燃烧生成水蒸气放出484kJ热量,则其热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-242kJ•mol-1 | |
| C. | 甲烷的标准燃烧热数值为890.3kJ/mol,则甲烷燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3kJ/mol | |
| D. | 已知稀溶液中,H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1,则浓硫酸与稀NaOH溶液反应生成1mol水时放出的热量为57.3kJ |
7.关于氧化镁和氧化铝比较的结论中不正确的是( )
| A. | 都能溶于浓盐酸或浓硝酸中 | |
| B. | 都能溶于氢氧化钠溶液中 | |
| C. | 它们的熔点都很高,常用做耐火材料 | |
| D. | 常温下都不能与水反应 |
4.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温下,1L0.1mol•L-1的NH4NO3溶液中氮原子数为0.2NA | |
| B. | 1mol羟基中电子数为10 NA | |
| C. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6 NA | |
| D. | 常温常压下,22.4L乙烯中C--H键数为4 NA |