题目内容
19.常温下,下列有关叙述正确的是( )| A. | 醋酸溶液加水稀释后,各离子浓度均减小 | |
| B. | 将Na2SO3溶液、FeCl3溶液蒸干均得不到原溶质 | |
| C. | 加热滴有酚酞的CH3COONa溶液,溶液颜色变浅 | |
| D. | 0.1 mol/L Na2CO3溶液中,c(HCO3-)>c(CO32-) |
分析 A、0.1 mol•L-1醋酸溶液加水稀释后,氢离子浓度减小,氢氧根离子浓度增大;
B、将Na2SO3溶液蒸干时,Na2SO3被氧化;FeCl3溶液蒸干时水解被促进;
C、盐类水解吸热;
D、盐类的单水解程度很小.
解答 解:A、0.1 mol•L-1醋酸溶液加水稀释后,氢离子浓度减小,由于Kw不变,所以氢氧根离子浓度增大,故A错误;
B、将Na2SO3溶液蒸干时,Na2SO3被氧化为Na2SO4;FeCl3溶液蒸干时水解被促进,最后得到Fe(OH)3,故均得不到原溶质,故B正确;
C、盐类水解吸热,故加热能促进其水解,故溶液碱性增强,则颜色变深,故C错误;
D、盐类的单水解程度很小,故水解生成的HCO3-浓度远小于未水解的CO32-的浓度,故D错误.
故选B.
点评 本题考查了盐类的水解及其应用,应注意的是将Na2SO3溶液蒸干时,Na2SO3被氧化,FeCl3溶液蒸干时水解被促进,均得不到溶质本身.

练习册系列答案
相关题目
9.设NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 1mol FeCl3完全转化为Fe(OH)3胶体后生成NA个胶体粒子 | |
| B. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为NA | |
| C. | 在标准状况下,22.4L H2和8 g 氦气均含有NA个分子 | |
| D. | 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02NA个 |
10.下列物质属于碱的是( )
| A. | CaO | B. | C2H5OH | C. | Na2CO3 | D. | KOH |
7.碘是一种重要的药用元素,缺乏碘能导致甲状腺肿大等.为预防碘缺乏病,目前我国的食盐都是“加碘食盐”.“加碘食盐”中加的是含碘元素的物质是碘酸钾(KIO3),KIO3属于( )
| A. | 酸 | B. | 碱 | C. | 盐 | D. | 氧化物 |
14.据报道,科学家最近发现了一种新的粒子,这种粒子是由3个1H原子核和2个电子构成.下列关于这种粒子的说法中,正确的是( )
| A. | 它是氢的一种新同位素 | |
| B. | 这种新元素的核电荷数是3 | |
| C. | 它是H2的一种新同素异形体 | |
| D. | 它比一个普通氢分子多-个氢原子核 |
11.某状况下1.5molO2的体积为30L,则该条件下2mol H2的体积为( )
| A. | 44.8L | B. | 40L | C. | 22.4L | D. | 30L |
8.0.9g某元素的单质直接跟氯气反应后,质量增加了3.55g,这种元素是( )
| A. | Na | B. | Mg | C. | Fe | D. | Al |
5.哈伯因发明了由氮气和氢气合成氨气的方法而获得1918年诺贝尔化学奖.现向一密闭容器中充入1molN2和3molH2,在一定条下使该反应发生.下列有关说法正确的是( )
| A. | 达到化学平衡时,N2将完全转化为NH3 | |
| B. | 达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等 | |
| C. | 达到化学平衡时,正反应和逆反应的速率都为零 | |
| D. | 达到化学平衡时,N2和H2的转化率相同且c(N2):c(H2)=1:3 |
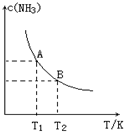 将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25%,反应中放出a kJ热量.
将1mol N2(g)和3mol H2(g)通入一个10L的恒容密闭容器中发生反应,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25%,反应中放出a kJ热量.